
(9分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下: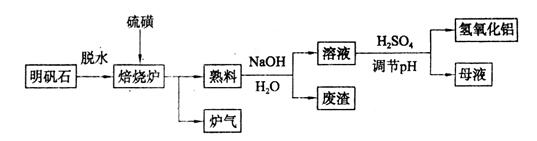
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S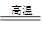 2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
(2)将标况下1.12L炉气通入100mL 0.5/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为_______________ _______。
(3)熟料溶解时反应的离子方程式为___________________________________。
(4)检验废渣中含有Fe2O3所需的试剂是____________。
(5)母液中溶质主要成分的化学式为__________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是_________________________。
(1)Al2(SO4)3(1分) 3.612x1024(1分) (2)c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)(1分)
(3)Al2O3+2OH-=2AlO2-+H2O(2分) (4)稀盐酸、硫氰化钾溶液(其他合理答案均可)(1分)
(5)K2SO4、Na2SO4(2分) 取最后的洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。(1分)
解析试题分析:(1)根据反应的方程式可知,单质S的化合价从0价升高到+4价,失去4个电子,作还原剂。硫酸铝中硫元素的化合价从+6价降低到+4价,得到2个电子,作氧化剂。根据方程式可知,生成1 mol Al2O3,则转移的电子物质的量是3×4mol÷2=6mol,个数是3.612x1024。
(2)炉气是SO2,物质的量是0.05mol,而氢氧化钠是0.05mol,所以二者恰好反应生成0.05molNaHSO3。溶液显酸性,说明水解程度大于电离程度,因此溶液中离子难度大小顺序是c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)。
(3)氧化铝是两性氧化物,和氢氧化钠溶液反应的方程式是Al2O3+2OH-=2AlO2-+H2O。
(4)氧化铁不能直接检验,应该溶于酸中生成铁盐后,通过检验铁离子来判断,因此需要的试剂是稀盐酸、硫氰化钾溶液。
(5)母液中的主要溶质是硫酸盐,根据明矾石中的阳离子以及后来加入的氢氧化钠溶液可知,硫酸盐是K2SO4、Na2SO4。沉淀表面有吸附的SO42-,所以可以通过检验SO42-来判断。即取最后的洗涤液于试管中,滴加BaCl2溶液,若无白色沉淀生成则已洗涤干净。
考点:考查氧化还原反应的有关计算和判断、溶液中离子浓度大小比较、物质的检验等
点评:该题以工业上制备氢氧化铝的流程图未载体,全面考查了学生对基础知识的掌握的程度、原理的理解。重点考查实验基本操作的规范性和准确及灵活运用知识的能力,该题属于中等难度的试题。


科目:高中化学 来源:2014届四川省高二“零诊”考试化学试卷(解析版) 题型:填空题
(9分)明矾石的主要成分是K2SO4·Al2(SO4)3·2Al2O3·6H2O,还含有少量Fe2O3杂质。利用明矾石制备氢氧化铝的流程如下:
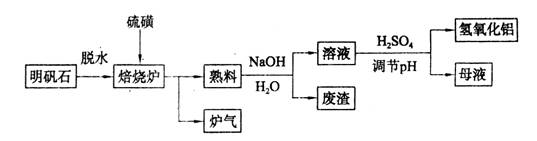
(1)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S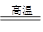 2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
2Al2O3+9SO2,该反应的氧化剂是_______,若生成1 mol Al2O3,则转移的电子数为_______。
(2)将标况下1.12L炉气通入100mL 0.5/L NaOH溶液中,得到一种酸性溶液,则该溶液中各种离子浓度由大到小的排列顺序为_______________ _______。
(3)熟料溶解时反应的离子方程式为___________________________________。
(4)检验废渣中含有Fe2O3所需的试剂是____________。
(5)母液中溶质主要成分的化学式为__________,溶液调节pH后经过滤、洗涤可得Al(OH)3沉淀,证明沉淀已洗涤干净的实验操作和现象是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com