
【题目】(1)19g某金属氯化物ACl2中含有0.4molCl-离子,则ACl2的摩尔质量是____________, A的相对原子质量是___________。
(2)同温同压下,质量相同的五种气体:①CO2②H2③O2④CH4⑤SO2,所占体积由大到小的顺序是(填序号,下同) ; 密度由大到小的顺序是 。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体的平均摩尔质量为 。
(4)VmLAl2(SO4)3溶液中含Al3+ ag,取V/4mL溶液稀释到VmL,则稀释后溶液中SO42-的物质的量浓度是 mol/L。
【答案】
(1)95g·mol-1;24;
(2)②④③①⑤;⑤①③④②;
(3)16.8g/mol;
(4)125a/9V
【解析】
试题分析:(1)19g某二价金属的氯化物ACl2中含有0.4mol Cl-,则ACl2的物质的量为0.2mol,摩尔质量=![]() =95g/mol;ACl2中A的相对原子质量=95-35.5×2=24;依据相对原子质量为24;故答案为:95g/mol;24;
=95g/mol;ACl2中A的相对原子质量=95-35.5×2=24;依据相对原子质量为24;故答案为:95g/mol;24;
(2)设质量均为mg,则物质的量分别为![]() mol、
mol、![]() mol、
mol、![]() mol、
mol、![]() mol、
mol、![]() mol,同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①⑤;由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,64>44>32>16>2,即密度由大到小的顺序为⑤①③④②,故答案为:②④③①⑤;⑤①③④②;
mol,同温同压下体积与物质的量成正比,则所占的体积由大到小的顺序是②④③①⑤;由pM=ρRT可知,密度与摩尔质量成正比,即摩尔质量越大,密度越大,64>44>32>16>2,即密度由大到小的顺序为⑤①③④②,故答案为:②④③①⑤;⑤①③④②;
(3)混合气体的平均摩尔质量=0.75g/L×22.4L/mol=16.8g/mol,故答案为:16.8g/mol;
(4)ag Al3+ 的物质的量为![]() =
=![]() mol,而n(SO42-)=
mol,而n(SO42-)=![]() n(Al3+)=
n(Al3+)=![]() mol,则
mol,则![]() mL溶液中SO42-的物质的量=
mL溶液中SO42-的物质的量=![]() mol×
mol×![]() =
=![]() mol,则
mol,则![]() mL溶液稀释到VmL,稀释后溶液中SO42-的物质的量浓度是
mL溶液稀释到VmL,稀释后溶液中SO42-的物质的量浓度是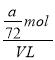 =
=![]() mol/L,故答案为:
mol/L,故答案为:![]() mol/L.
mol/L.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中不正确的是( )

①分子式为C12H20O2
②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C ②④⑥ D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程需要吸收热量的是
A. Na与H2O反应 B. 铝与磁性氧化铁在高温下反应
C. 形成氨气中的N-H键 D. Ba(OH)2·8H2O晶体与NH4Cl晶体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生 的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaO(s)+SO2(g)+CO2(g) △H1=+218.4kJ/mol(反应I)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
CaS(s)+4CO2(g) △H2=-175.6kJmol-l(反应II)
请冋答下列问题:
(1)反应I能够自发进行的条件是____________。
(2)对于气体参与的反应,表示平衡常数Kp时用气体组分(B)的平衡压强p(B)代替该气体物质的量浓度c(B),则反应II的Kp="___________" (用表达式表示)。
(3)假设某温度下,反应I的速率(v1)大于反应II的速率(v2),则下列反应过程能量变化示意图正确的是______________。

(4)通过监测反应体系中气体浓度的变化判断反应I和II是否同时发生,理由是___________。
(5)图I为实验测得不同温度下反应体系中CO初始体积百分数与平衡时固体产物中CaS质量百分数的关系曲线。则降低该反应体系中SO2生成量的措施有__________。
A.向该反应体系中投入石灰石 B.在合适的温度区间内控制较低的反应温度
C.提高CO的初始体积百分数 D.提高反应体系的温度
(6)恒温恒容条件下,假设反应I和II同时发生,且v1>v2,请在图2中画出反应体系中c(SO2)
随时间t变化的总趋势图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016新课标2】下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由甲醇、氧气和强碱溶液(作电解质)组成的新型手机电池,可持续使用一个月,其电池反应为:2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,则有关说法正确的是( )
2CO32-+6H2O,则有关说法正确的是( )
A.放电时CH3OH参与反应的电极为正极
B.放电时负极的电极反应为CH3OH+8OH--6e-=CO32-+6H2O
C.标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D.放电一段时间后,通入氧气的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活必需品,也是重要的化工原料。
(1)某种粗盐含有少量Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯该粗盐的流程如下:
粗盐溶解![]()
![]() 滤液
滤液![]()
![]() 纯NaCl
纯NaCl
提供的试剂有:a.饱和Na2CO3溶液 b.饱和K2CO3溶液 c.NaOH溶液 d.BaCl2溶液 e.Ba(NO3)2溶液
欲除去粗盐溶液中的Ca2+、Mg2+、Fe3+、SO42-离子,需依次加入三种试剂,顺序依次为
(填序号); ;
(2)食盐是工业上生产氯气和烧碱的重要原料。下图是工业上电解饱和食盐水的离子交换膜电解槽示 意图(阳极用金属钛网制成,阴极由碳钢网制成)。
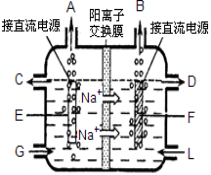
①F电极是 (填阴极或阳极);G处进口的物质是 ;
电解总反应的离子方程式为: 。
②通电几分钟后,如果将直流电源的正负极与电极接反,在电极F附近可以观察到的现象是 。
(3)采用无膜电解槽电解饱和食盐水(离子交换膜更换为搅拌器),可制取次氯酸钠溶液作消毒液,制取消毒液的离子反应方程式为 ,当收集到22.4L标准状况下的H2时,理论上所得混合溶液中次氯酸钠的质量最多为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸溶液中c(H+)=0.1 mol·L-1,则该溶液的物质的量浓度
A. 一定等于0.1 mol·L-1 B. 一定大于0.1 mol·L-1
C. 一定小于0.1 mol·L-1 D. 无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com