
| A. | 中和时所需HCl的量 | B. | NH3•H2O的电离常数 | ||
| C. | OH-的物质的量 | D. | OH-的浓度 |
分析 根据氨水的浓度越小,其电离程度越大,但溶液的浓度小,电离产生的离子的浓度小,据此分析.
解答 解:A.由n=cV可知,100mL 0.01mol/L的NH3•H2O与10mL0.1mol/L的NH3•H2O中溶质的物质的量都是0.001mol,则中和时所需HCl的量相等,故A错误;
B.电离常数只与温度有关,温度相同,电离常数相同,故B错误;
C.溶液越稀,电解质的电离程度越大,所以OH-的物质的量前者大于后者,故C正确;
D.相同温度下,0.01mol/L的NH3•H2O小于0.1mol/L的NH3•H2O的浓度,则前者电离产生的氢氧根离子浓度小于后者,故D错误.
故选C.
点评 本题考查弱电解质的电离,题目难度不大,本题注意一水合氨为弱电解质,浓度不同,电离程度不同,浓度越大,电离程度越小的特征.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{8}^{16}$O、${\;}_{8}^{17}$O、${\;}_{8}^{18}$O互为同素异形体 | |
| B. | O2与O3互为同位素 | |
| C. | CH3-CH2-OH与CH3-O-CH3互为分异构体 | |
| D. | H2O与D2O互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH.若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| C. | 用0.2000 mol•L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1 mol•L-1),当pH=7时,溶液中的酸恰好完全中和 | |
| D. | 相同温度下,将足量氯化银固体分别放入相同体积的①蒸馏水、②0.1 mol•L-1盐酸、③0.1 mol•L-1氯化镁溶液、④0.1 mol•L-1硝酸银溶液中,Ag+浓度:④>①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由水电离产生的c(OH-)=10-12mol•L-1 | |
| B. | 向溶液中加入等体积的pH=2盐酸后溶液呈酸性 | |
| C. | 向溶液中加入稀盐酸可以促进氨水的电离,溶液的碱性增强 | |
| D. | 向溶液中加入适量盐酸使混合液的pH=7,混合液中c(NH4+)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 25℃,电离平衡常数:
25℃,电离平衡常数:| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
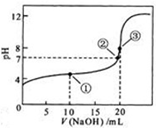
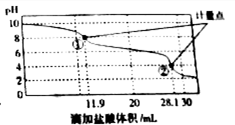 称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )
称取Na2CO3和NaHCO3混合物样品1.6226g,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol•L-1 盐酸滴定,得到如图曲线.以下说法错误的是( )| A. | 样品中Na2CO3含量越高,起始pH也越大 | |
| B. | 计量点①中有关离子浓度关系为:c(HCO3-)>C(Cl-)>c(CO32-) | |
| C. | 计量点②溶液中有关离子浓度关系为:2(CO32-)+c(HCO3-)=C(H+)-c(OH-) | |
| D. | 此样品n(NaHCO3)=(28.1-11.9)×10-3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.0 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指大气中直径≤2,5微米的颗粒物也称为可入肺颗粒物,对人体危害最大是因为它可以直接进入肺泡 | |
| B. | 雾霾是因为汽车排放尾气,工厂排放废气,燃烧烟花爆竹、烹饪等原因所造成的 | |
| C. | 化石能源不仅不可再生,而且在燃烧过程中会产生染污性物质,因此应不再使用化石能源,这符合绿色化学的核心 | |
| D. | 对煤进行气化、液化、脱硫等处理,不仅可以提高其利用率,而且可以降低对环境的污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com