
”¾ĢāÄæ”æ¼×”¢ŅŅ×éĶ¬Ń§·Ö±š×öĮĖŅŌĻĀĢ½¾æŹµŃ锣
(1)¼××éĢ½¾æ![]() Óė
Óė![]() ČÜŅŗ·“Ó¦£¬ŹµŃé×°ÖĆČēĻĀ£ŗ
ČÜŅŗ·“Ó¦£¬ŹµŃé×°ÖĆČēĻĀ£ŗ
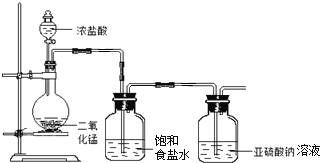
¢ŁĒėÖø³öøĆ×°ÖĆµÄ²»×ćÖ®“¦ ______ ”¢ ______ ”£
¢Ś![]() Óė
Óė![]() ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ______ ”£
ČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ______ ”£
¢ŪÉč¼ĘŹµŃ飬¼ņŹöŹµŃé²½Öč£¬Ö¤Ć÷Ļ“ĘųĘæÖŠµÄ![]() Ņѱ»Ńõ»Æ ______ ”£
Ņѱ»Ńõ»Æ ______ ”£
(2)ŅŅ×éĢ½¾æŅŅĖįŅŅõ„![]() ·Šµć
·Šµć![]() ŌŚ²»Ķ¬ĪĀ¶Č”¢²»Ķ¬ÅضČNaOHČÜŅŗÖŠµÄĖ®½āĖŁĀŹ”£Č”ĖÄÖ§“óŠ”ĻąĶ¬µÄŹŌ¹Ü£¬ŌŚŹŌ¹ÜĶā±ŚĢłÉĻĢå»żæĢ¶ČÖ½£¬°“ĻĀ±ķ½ųŠŠ¶ŌÕÕŹµŃ锣ŌŚĮ½ÖÖ²»Ķ¬ĪĀ¶ČµÄĖ®Ō”ÖŠ¼ÓČČĻąĶ¬Ź±¼äŗ󣬼ĒĀ¼õ„²ćµÄĢå»żĄ“Č·¶ØĖ®½ā·“Ó¦µÄĖŁĀŹ
ŌŚ²»Ķ¬ĪĀ¶Č”¢²»Ķ¬ÅضČNaOHČÜŅŗÖŠµÄĖ®½āĖŁĀŹ”£Č”ĖÄÖ§“óŠ”ĻąĶ¬µÄŹŌ¹Ü£¬ŌŚŹŌ¹ÜĶā±ŚĢłÉĻĢå»żæĢ¶ČÖ½£¬°“ĻĀ±ķ½ųŠŠ¶ŌÕÕŹµŃ锣ŌŚĮ½ÖÖ²»Ķ¬ĪĀ¶ČµÄĖ®Ō”ÖŠ¼ÓČČĻąĶ¬Ź±¼äŗ󣬼ĒĀ¼õ„²ćµÄĢå»żĄ“Č·¶ØĖ®½ā·“Ó¦µÄĖŁĀŹ
ŹŌ¹Ü¢ń | ŹŌ¹Ü¢ņ | ŹŌ¹Ü¢ó | ŹŌ¹Ü¢ō | |
ŅŅĖįŅŅõ„ | 1 | V1 | V2 | V3 |
| V4 | 3 | 0 | V5 |
ÕōĮóĖ® | 0 | V6 | 5 | 2 |
¢ÜĒėĶź³ÉÉĻ±ķ£¬ĘäÖŠ![]() ______ £¬
______ £¬![]() ______ £¬
______ £¬![]() ______ ”£
______ ӣ
¢ŻŹµŃéÖŠ£¬æÉÓƱ„ŗĶŹ³ŃĪĖ®Ģę“śÕōĮóĖ®£¬ĘäÓŵćŹĒ ______ £»µ«²»ÄÜÓƱ„ŗĶ![]() ČÜŅŗĢę“śÕōĮóĖ®£¬ĘäŌŅņŹĒ ______ ”£
ČÜŅŗĢę“śÕōĮóĖ®£¬ĘäŌŅņŹĒ ______ ”£
¢ŽŹµŃéÖŠ£¬ŹŌ¹Ü¢ō±ČŹŌ¹Ü¢ņÖŠµÄõ„²ć¼õÉŁøüæģ£¬ĘäŌŅņÓŠ£ŗĪĀ¶ČøßĖŁĀŹæģ£¬»¹æÉÄÜÓŠ ______”£
”¾“š°ø”æƻӊ¼ÓČČ×°ÖĆ Ć»ÓŠĪ²Ęų“¦Ąķ×°ÖĆ ![]() ȔɣĮæĻ“ĘųĘæÖŠµÄŅŗĢåÓŚøɾ»ŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæŃĪĖį
ȔɣĮæĻ“ĘųĘæÖŠµÄŅŗĢåÓŚøɾ»ŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæŃĪĖį![]() µĪ¼ÓĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųĢå
µĪ¼ÓĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųĢå![]() £¬ŌŁµĪ¼ÓÉŁĮæµÄĀČ»Æ±µČÜŅŗ£¬Čō²śÉś°×É«³Įµķ£¬ŌņÖ¤Ć÷ŅŃ¾±»Ńõ»Æ 1 5 3 æɼõŠ”ŅŅĖįŅŅõ„ŌŚĖ®ÖŠµÄČܽā¶Č£¬Ź¹ŹµŃé½į¹ūøü×¼Č· Ģ¼ĖįÄĘČÜŅŗĖ®½āĻŌ¼īŠŌ£¬øÉČÅĮĖĢ½¾æNaOHČÜŅŗ¶ŌĖ®½āĖŁĀŹµÄÓ°Ļģ Ė®Ō”ĪĀ¶Č½Ó½üŅŅĖįŅŅõ„µÄ·Šµć£¬ĪĀ¶ČŌ½øߣ¬ŅŅĖįŅŅõ„»Ó·¢Ņ²Ō½æģ£¬Ōņõ„²ć¼õÉŁøüæģ
£¬ŌŁµĪ¼ÓÉŁĮæµÄĀČ»Æ±µČÜŅŗ£¬Čō²śÉś°×É«³Įµķ£¬ŌņÖ¤Ć÷ŅŃ¾±»Ńõ»Æ 1 5 3 æɼõŠ”ŅŅĖįŅŅõ„ŌŚĖ®ÖŠµÄČܽā¶Č£¬Ź¹ŹµŃé½į¹ūøü×¼Č· Ģ¼ĖįÄĘČÜŅŗĖ®½āĻŌ¼īŠŌ£¬øÉČÅĮĖĢ½¾æNaOHČÜŅŗ¶ŌĖ®½āĖŁĀŹµÄÓ°Ļģ Ė®Ō”ĪĀ¶Č½Ó½üŅŅĖįŅŅõ„µÄ·Šµć£¬ĪĀ¶ČŌ½øߣ¬ŅŅĖįŅŅõ„»Ó·¢Ņ²Ō½æģ£¬Ōņõ„²ć¼õÉŁøüæģ
”¾½āĪö”æ
(1)¢Łøł¾ŻŹµŃéŹŅÖĘČ”ĀČĘųµÄ·“Ó¦ŌĄķ¼°ĀČĘųÓŠ¶¾µČ·½Ćę½ųŠŠ·ÖĪö£»
¢ŚĀČĘų¾ßÓŠĒæŃõ»ÆŠŌ£¬Äܹ»½«ŃĒĮņĖįÄĘŃõ»Æ³ÉĮņĖįÄĘ£»
¢ŪŃĒĮņĖįÄʱ»Ńõ»Æ³ÉĮņĖįÄĘ£¬Ķعż¼ģŃéĮņĖįøłĄė×ÓæÉŅŌÖ¤Ć÷ŃĒĮņĖįÄʱ»Ńõ»Æ£»
(2)¢Üøł¾ŻŹµŃéÄæµÄ”°ŅŅ×éĢ½¾æŅŅĖįŅŅõ„![]() ·Šµć
·Šµć![]() ŌŚ²»Ķ¬ĪĀ¶Č”¢²»Ķ¬ÅضČNaOHČÜŅŗÖŠµÄĖ®½āĖŁĀŹ”±¼°¶ŌÕÕŹŌŃéµÄÉč¼ĘŌŌņ½ųŠŠÅŠ¶Ļ£»
ŌŚ²»Ķ¬ĪĀ¶Č”¢²»Ķ¬ÅضČNaOHČÜŅŗÖŠµÄĖ®½āĖŁĀŹ”±¼°¶ŌÕÕŹŌŃéµÄÉč¼ĘŌŌņ½ųŠŠÅŠ¶Ļ£»
¢Żøł¾ŻŅŅĖįŅŅõ„ŌŚ±„ŗĶŹ³ŃĪĖ®ÖŠµÄČܽā¶Č¼õŠ”·½Ćęæ¼ĀĒ£»øł¾ŻĢ¼ĖįÄĘČÜŅŗĖ®½āĻŌŹ¾¼īŠŌ·ÖĪö£»
¢Žøł¾ŻŅŅĖįŅŅõ„µÄ·ŠµćĪŖ![]() £¬
£¬![]() Ź±ŅŅĖįŅŅõ„ČŻŅ×»Ó·¢·ÖĪö”£
Ź±ŅŅĖįŅŅõ„ČŻŅ×»Ó·¢·ÖĪö”£
(1)¢ŁÅØŃĪĖįÓė¶žŃõ»ÆĆĢÖĘČ”ĀČĘųµÄ·“Ó¦ŠčŅŖ¼ÓČČ£¬ĀČĘųÓŠ¶¾£¬Ó¦øĆŹ¹ÓĆĪ²ĘųĪüŹÕ×°ÖĆ£¬¹Ź“š°øĪŖ£ŗƻӊ¼ÓČČ×°ÖĆ£»Ć»ÓŠĪ²Ęų“¦Ąķ×°ÖĆ£»
¢ŚĀČĘųÓėŃĒĮņĖįÄĘČÜŅŗ·“Ӧɜ³ÉĮņĖįÄĘŗĶĀČ»ÆĒā£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ![]() £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ![]() £»
£»
¢ŪČōĻ“ĘųĘæÖŠµÄ![]() Ņѱ»Ńõ»Æ£¬ŌņĻ“ĘųĘæµÄČÜŅŗÖŠÓ¦øĆ“ęŌŚĮņĖįøłĄė×Ó£¬¼ģŃé·½·ØĪŖ£ŗȔɣĮæĻ“ĘųĘæÖŠµÄŅŗĢåÓŚøɾ»ŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæŃĪĖį
Ņѱ»Ńõ»Æ£¬ŌņĻ“ĘųĘæµÄČÜŅŗÖŠÓ¦øĆ“ęŌŚĮņĖįøłĄė×Ó£¬¼ģŃé·½·ØĪŖ£ŗȔɣĮæĻ“ĘųĘæÖŠµÄŅŗĢåÓŚøɾ»ŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæŃĪĖį![]() µĪ¼ÓĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųĢå
µĪ¼ÓĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųĢå![]() £¬ŌŁµĪ¼ÓÉŁĮæµÄĀČ»Æ±µČÜŅŗ£¬Čō²śÉś°×É«³Įµķ£¬ŌņÖ¤Ć÷ŅŃ¾±»Ńõ»Æ£¬¹Ź“š°øĪŖ£ŗȔɣĮæĻ“ĘųĘæÖŠµÄŅŗĢåÓŚøɾ»ŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæŃĪĖį
£¬ŌŁµĪ¼ÓÉŁĮæµÄĀČ»Æ±µČÜŅŗ£¬Čō²śÉś°×É«³Įµķ£¬ŌņÖ¤Ć÷ŅŃ¾±»Ńõ»Æ£¬¹Ź“š°øĪŖ£ŗȔɣĮæĻ“ĘųĘæÖŠµÄŅŗĢåÓŚøɾ»ŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæŃĪĖį![]() µĪ¼ÓĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųĢå
µĪ¼ÓĻ”ŃĪĖįÖĮ²»ŌŁ²śÉśĘųĢå![]() £¬ŌŁµĪ¼ÓÉŁĮæµÄĀČ»Æ±µČÜŅŗ£¬Čō²śÉś°×É«³Įµķ£¬ŌņÖ¤Ć÷ŅŃ¾±»Ńõ»Æ£»
£¬ŌŁµĪ¼ÓÉŁĮæµÄĀČ»Æ±µČÜŅŗ£¬Čō²śÉś°×É«³Įµķ£¬ŌņÖ¤Ć÷ŅŃ¾±»Ńõ»Æ£»
(2)¢ÜŅŅ×éĢ½¾æŅŅĖįŅŅõ„![]() ·Šµć
·Šµć![]() ŌŚ²»Ķ¬ĪĀ¶Č”¢²»Ķ¬ÅضČNaOHČÜŅŗÖŠµÄĖ®½āĖŁĀŹ£¬ĖÄøöŹŌ¹ÜÖŠŅŅĖįŅŅõ„µÄĢå»ż¶¼Ó¦øĆĪŖ1mL£¬¼“£ŗ
ŌŚ²»Ķ¬ĪĀ¶Č”¢²»Ķ¬ÅضČNaOHČÜŅŗÖŠµÄĖ®½āĖŁĀŹ£¬ĖÄøöŹŌ¹ÜÖŠŅŅĖįŅŅõ„µÄĢå»ż¶¼Ó¦øĆĪŖ1mL£¬¼“£ŗ![]() £»ŅņŹµŃéĢ½¾æµÄŹĒĪĀ¶Č”¢NaOHÅØ¶Č¶ŌŅŅĖįŅŅõ„Ė®½āĖŁĀŹµÄÓ°Ļģ£¬Ņņ“ĖŅŅĖįŅŅõ„µÄÅضČÓ¦±£³ÖŅ»Ńł£¬Ōņ±ŲŠė±£Ö¤ČÜŅŗ×ÜĢå»żĻąµČ£¬ÓÉŹŌ¹Ü¢óæÉÖŖČÜŅŗ×ÜĢå»żĪŖ6mL£¬Ōņ
£»ŅņŹµŃéĢ½¾æµÄŹĒĪĀ¶Č”¢NaOHÅØ¶Č¶ŌŅŅĖįŅŅõ„Ė®½āĖŁĀŹµÄÓ°Ļģ£¬Ņņ“ĖŅŅĖįŅŅõ„µÄÅضČÓ¦±£³ÖŅ»Ńł£¬Ōņ±ŲŠė±£Ö¤ČÜŅŗ×ÜĢå»żĻąµČ£¬ÓÉŹŌ¹Ü¢óæÉÖŖČÜŅŗ×ÜĢå»żĪŖ6mL£¬Ōņ![]() £¬
£¬![]() £¬
£¬![]() £¬ŹŌ¹ÜI”¢ŹŌ¹Ü¢ņ”¢ŹŌ¹Ü¢óĢ½¾æNaOHÅØ¶Č¶ŌŅŅĖįŅŅõ„µÄĖ®½āĖŁĀŹµÄÓ°Ļģ£¬ŹŌ¹Ü¢ōŗĶŹŌ¹Ü¢ņĢ½¾æĪĀ¶Č¶ŌŅŅĖįŅŅõ„Ė®½āĖŁĀŹµÄÓ°Ļģ£¬¹Ź“š°øĪŖ£ŗ1£»5£»3£»
£¬ŹŌ¹ÜI”¢ŹŌ¹Ü¢ņ”¢ŹŌ¹Ü¢óĢ½¾æNaOHÅØ¶Č¶ŌŅŅĖįŅŅõ„µÄĖ®½āĖŁĀŹµÄÓ°Ļģ£¬ŹŌ¹Ü¢ōŗĶŹŌ¹Ü¢ņĢ½¾æĪĀ¶Č¶ŌŅŅĖįŅŅõ„Ė®½āĖŁĀŹµÄÓ°Ļģ£¬¹Ź“š°øĪŖ£ŗ1£»5£»3£»
¢ŻÓÉÓŚŅŅĖįŅŅõ„ŌŚ±„ŗĶŹ³ŃĪĖ®ÖŠµÄČܽā¶Č¼õŠ”£¬¹ŹŹµŃéÖŠ£¬æÉÓƱ„ŗĶŹ³ŃĪĖ®Ģę“śÕōĮóĖ®£¬ŅŌ±ć¼õŠ”ŅŅĖįŅŅõ„ŌŚĖ®ÖŠµÄČܽā¶Č£¬Ź¹ŹµŃé½į¹ūøü×¼Č·£»µ«Ģ¼ĖįÄĘČÜŅŗĖ®½āĻŌ¼īŠŌ£¬øÉČÅĮĖĢ½¾æNaOHČÜŅŗ¶ŌĖ®½āĖŁĀŹµÄÓ°Ļģ£¬ĖłŅŌ²»ÄÜÓƱ„ŗĶ![]() ČÜŅŗĢę“śÕōĮóĖ®£¬¹Ź“š°øĪŖ£ŗæɼõŅŅĖįŅŅõ„ŌŚĖ®ÖŠµÄČܽā¶Č£¬Ź¹ŹµŃé½į¹ūøü×¼Č·£»Ģ¼ĖįÄĘČÜŅŗĖ®½āĻŌ¼īŠŌ£¬øÉČÅĮĖĢ½¾æNaOHČÜŅŗ¶ŌĖ®½āĖŁĀŹµÄÓ°Ļģ£»
ČÜŅŗĢę“śÕōĮóĖ®£¬¹Ź“š°øĪŖ£ŗæɼõŅŅĖįŅŅõ„ŌŚĖ®ÖŠµÄČܽā¶Č£¬Ź¹ŹµŃé½į¹ūøü×¼Č·£»Ģ¼ĖįÄĘČÜŅŗĖ®½āĻŌ¼īŠŌ£¬øÉČÅĮĖĢ½¾æNaOHČÜŅŗ¶ŌĖ®½āĖŁĀŹµÄÓ°Ļģ£»
¢ŽŅŅĖįŅŅõ„µÄ·ŠµćĪŖ![]() £¬Ė®Ō”ĪĀ¶Č½Ó½üŅŅĖįŅŅõ„µÄ·Šµć£¬ĪĀ¶ČŌ½øߣ¬ŅŅĖįŅŅõ„»Ó·¢Ņ²Ō½æģ£¬µ¼ÖĀŹŌ¹ÜÖŠõ„²ć¼õÉŁĖŁĀŹ¼Óæģ£¬øÉČÅĮĖŹµŃé½į¹ū£¬¹Ź“š°øĪŖ£ŗĖ®Ō”ĪĀ¶Č½Ó½üŅŅĖįŅŅõ„µÄ·Šµć£¬ĪĀ¶ČŌ½øߣ¬ŅŅĖįŅŅõ„»Ó·¢Ņ²Ō½æģ£¬Ōņõ„²ć¼õÉŁøüæģ”£
£¬Ė®Ō”ĪĀ¶Č½Ó½üŅŅĖįŅŅõ„µÄ·Šµć£¬ĪĀ¶ČŌ½øߣ¬ŅŅĖįŅŅõ„»Ó·¢Ņ²Ō½æģ£¬µ¼ÖĀŹŌ¹ÜÖŠõ„²ć¼õÉŁĖŁĀŹ¼Óæģ£¬øÉČÅĮĖŹµŃé½į¹ū£¬¹Ź“š°øĪŖ£ŗĖ®Ō”ĪĀ¶Č½Ó½üŅŅĖįŅŅõ„µÄ·Šµć£¬ĪĀ¶ČŌ½øߣ¬ŅŅĖįŅŅõ„»Ó·¢Ņ²Ō½æģ£¬Ōņõ„²ć¼õÉŁøüæģ”£


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”ææĘѧ¹¤×÷ÕßŃŠ·¢ĮĖŅ»ÖÖ SUNCATµÄĻµĶ³£¬½čÖśļ®Ń»·æɳ֊ųŗĻ³É°±£¬ĘäŌĄķČēĻĀĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ
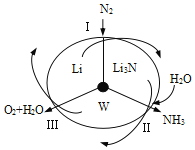
A. ¹ż³ĢIµĆµ½µÄLi3NÖŠNŌŖĖŲĪŖ”Ŗ3¼Ū
B. ¹ż³Ģ¢ņÉś³ÉWµÄ·“Ó¦ĪŖLi3N+3H2O===3LiOH+NH3”ü
C. ¹ż³Ģ¢óÖŠÄÜĮæµÄ×Ŗ»ÆŠĪŹ½ĪŖ»ÆѧÄÜ×Ŗ»ÆĪŖµēÄÜ
D. ¹ż³Ģ¢óÉę¼°µÄ·“Ó¦ĪŖ4OH££4e££½O2”ü+2H2O
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬Ļņ20.00mL0.100molL-1µÄ°±Ė®ŗĶ“×Ėįļ§ČÜŅŗÖŠ·Ö±šµĪ¼Ó0.100molL-1µÄŃĪĖįČÜŅŗ£¬ČÜŅŗpHĖę¼ÓČėŃĪĖįĢå»żµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
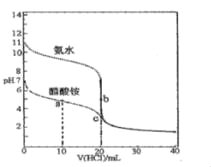
A.25”ꏱ£¬Kb£ØNH3H2O£©£½Ka£ØCH3COOH£©”Ö10-5
B.bµćČÜŅŗÖŠĖ®µÄµēĄė³Ģ¶Č±ČcµćČÜŅŗÖŠµÄ“ó
C.ŌŚcµćµÄČÜŅŗÖŠ£ŗc£ØCl©£©£¾c£ØCH3COOH£©£¾c£ØNH4+£©£¾c£ØOH©£©
D.ŌŚaµćµÄČÜŅŗÖŠ£ŗc£ØNH4+£©+2c£ØH+£©ØT2c£ØCH3COO-£©+c£ØNH3H2O£©+2c£ØOH-£©
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖKsp(AgCl)£½1.56”Į10£10£¬Ksp(AgBr)£½7.7”Į10£13£¬Ksp(Ag2CrO4)£½9.0”Į10£12”£Ä³ČÜŅŗÖŠŗ¬ÓŠCl£”¢Br£ŗĶCrO42”Ŗ£¬ÅØ¶Č¾łĪŖ0.010 mol”¤L£1£¬ĻņøĆČÜŅŗÖŠÖšµĪ¼ÓČė0.010 mol”¤L£1µÄAgNO3ČÜŅŗŹ±£¬ČżÖÖŅõĄė×Ó²śÉś³ĮµķµÄĻČŗóĖ³ŠņĪŖ(””””)
A.Cl£”¢Br£”¢CrO42”ŖB.CrO42”Ŗ”¢Br£”¢Cl£C.Br£”¢Cl£”¢CrO42”Ŗ D.Br£”¢CrO42”Ŗ”¢Cl£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»¶ØĪĀ¶ČĻĀ£¬ČōŌŚ![]() ŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėµČĪļÖŹµÄĮæµÄCOŗĶ
ŗćČŻĆܱÕČŻĘ÷ÖŠ£¬Ķ¶ČėµČĪļÖŹµÄĮæµÄCOŗĶ![]() £¬·¢ÉśæÉÄę·“Ó¦£ŗ
£¬·¢ÉśæÉÄę·“Ó¦£ŗ![]() £¬ÖĮ2minŹ±ČŻĘ÷ÄŚŗ¬ÓŠ
£¬ÖĮ2minŹ±ČŻĘ÷ÄŚŗ¬ÓŠ![]()
![]() £¬ŅŌĻĀÓŠ¹ŲĆčŹöÕżČ·µÄŹĒ
£¬ŅŌĻĀÓŠ¹ŲĆčŹöÕżČ·µÄŹĒ
¢Ł“ļĘ½ŗā¹ż³ĢÖŠ£¬COŗĶ![]() µÄĪļÖŹµÄĮæÖ®±ČŹ¼ÖÕ±£³Ö²»±ä
µÄĪļÖŹµÄĮæÖ®±ČŹ¼ÖÕ±£³Ö²»±ä
¢Ś“ļĘ½ŗā¹ż³ĢÖŠ£¬![]() ŗĶFeµÄĪļÖŹµÄĮæÖ®±ČŹ¼ÖÕ±£³Ö²»±ä
ŗĶFeµÄĪļÖŹµÄĮæÖ®±ČŹ¼ÖÕ±£³Ö²»±ä
¢Ū![]() ÄŚ£¬ŅŌCO±ķŹ¾øĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ
ÄŚ£¬ŅŌCO±ķŹ¾øĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ![]()
¢Ü![]() ÄŚ£¬ŅŌ
ÄŚ£¬ŅŌ![]() ±ķŹ¾øĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ
±ķŹ¾øĆ·“Ó¦µÄ»Æѧ·“Ó¦ĖŁĀŹĪŖ![]()
A.¢Ł¢ŚB.¢Ś¢ŪC.¢Ū¢ÜD.¢Ł¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠ·“Ó¦²»ŹōÓŚĖ®½ā·“Ó¦»ņĖ®½ā·½³ĢŹ½²»ÕżČ·µÄŹĒ (””””)
¢ŁHCl£«H2O![]() H3O£«£«Cl£
H3O£«£«Cl£
¢ŚAlCl3£«3H2O=Al(OH)3£«3HCl
¢ŪNa2CO3£«2H2O![]() H2CO3£«2NaOH
H2CO3£«2NaOH
¢ÜĢ¼ĖįĒāÄĘČÜŅŗ£ŗHCO3”Ŗ£«H2O=CO32”Ŗ£«H3O£«
¢ŻNH4ClČÜÓŚD2OÖŠ£ŗNH4+£«D2O![]() NH3”¤D2O£«H£«
NH3”¤D2O£«H£«
A.¢Ł¢Ś¢Ū¢ÜB.¢Ł¢Ś¢ŪC.¢Ś¢Ū¢ŻD.Č«²æ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬½«ÅØ¶Č¾łĪŖ0.1 mol”¤L£1£¬Ģå»ż·Ö±šĪŖVaŗĶVbµÄHAČÜŅŗÓėBOHČÜŅŗ°“²»Ķ¬Ģå»ż±Č»ģŗĻ£¬±£³ÖVa+Vb£½100 mL£¬Va”¢VbÓė»ģŗĻŅŗpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ

A. Ka(HA)£½1”Į10£6
B. bµćc(B+)£½c(A£)£½c(OH£)£½c(H+)
C. a”śc¹ż³ĢÖŠĖ®µÄµēĄė³Ģ¶ČŹ¼ÖÕŌö“ó
D. cµćŹ±£¬c(A£)/[c(OH£)c(HA)]ĖęĪĀ¶ČÉżø߶ų¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆĖįŠŌĒāŃõČ¼ĮĻµē³Ųµē½āæąĀ±Ė®(ŗ¬Cl£”¢Br£”¢Na£«”¢Mg2£«)µÄ×°ÖĆČēĶ¼ĖłŹ¾(a”¢bĪŖŹÆÄ«µē¼«)”£ĻĀĮŠĖµ·ØÖŠ£¬ÕżČ·µÄŹĒ

A£®µē³Ų¹¤×÷Ź±£¬Õż¼«·“Ó¦Ź½ĪŖO2£«2H2O£«4e£===4OH£
B£®µē½āŹ±£¬aµē¼«ÖÜĪ§Ź×ĻČ·ÅµēµÄŹĒCl££¬¶ų²»ŹĒBr£
C£®µē½āŹ±£¬µē×ÓĮ÷¶ÆĀ·¾¶ŹĒ£ŗøŗ¼«ØD”śĶāµēĀ·ØD”śŅõ¼«ØD”śČÜŅŗØD”śŃō¼«ØD”śÕż¼«
D£®ŗöĀŌÄÜĮæĖšŗÄ£¬µ±µē³ŲÖŠĻūŗÄ0.02 g H2Ź±£¬b¼«ÖÜĪ§»į²śÉś0.02 g H2
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ±ź×¼×“æöĻĀÓŠ¢Ł6.72L CH4£¬¢Ś3.01”Į1023øöHCl·Ö×Ó£¬¢Ū13.6gĮņ»ÆĒā£¬¢Ü0.2mol°±Ęų£ØNH3£©”£ĻĀĮŠ¶ŌÕāĖÄÖÖĘųĢåµÄ¹ŲĻµ“ӓ󵽊”ĆčŹö²»ÕżČ·µÄŹĒ£Ø””””£©
A.Ģå»ż¢Ś£¾¢Ū£¾¢Ł£¾¢ÜB.ĆÜ¶Č¢Ś£¾¢Ū£¾¢Ü£¾¢Ł
C.ÖŹĮæ¢Ś£¾¢Ū£¾¢Ł£¾¢ÜD.ĒāŌ×ÓŹż¢Ł£¾¢Ü£¾¢Ū£¾¢Ś
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com