
| A. | Al→[Al(OH)4]- | B. | Na2CO3→NaOH | C. | Al2O3→Al(OH)3 | D. | Fe(OH)2→Fe(OH)3 |
分析 A.Al能与NaOH反应;
B.碳酸钠与氢氧化钙反应;
C.氧化铝不溶于水,与水不反应;
D.氢氧化亚铁易被氧化.
解答 解:A.Al$\stackrel{NaOH、H_{2}O}{→}$[Al(OH)4]-,可一步转化,故A不选;
B.Na2CO3$\stackrel{Ca(OH)_{2}}{→}$NaOH,可一步转化,故B不选;
C.Al2O3→Al(OH)3不能一步完成,故C选;
D.Fe(OH)2$\stackrel{O_{2}、H_{2}O}{→}$Fe(OH)3,可一步转化,故D不选;
故选C.
点评 本题考查元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力考查,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
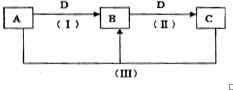 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).根据题意回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
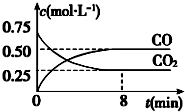 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2和CO的浓度与时间的关系如图所示.| 甲 | 乙 | |
| 量 | 3mo Fe、 mo CO | mo FeO、 3mo CO |
| CO浓度(mo•-1) | c1 | c |
| CO体积分数 | φ1 | φ |
| 体系压强(Pa) | p1 | p |
| 气态转化率 | α1 | α |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
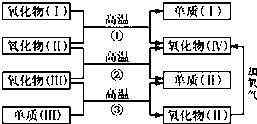 一些氧化物和单质之间可发生如图所示的反应:
一些氧化物和单质之间可发生如图所示的反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧杯 | B. | 玻璃棒 | C. | 容量瓶 | D. | 分液漏斗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(Na+)+c(H+)═c(HRO3-)+c(RO32-)+c(OH-) | |
| C. | c(RO32-)+c(HRO3-)+c(H2RO3)═c(Na+) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙酸 | B. | 乙醇 | C. | 水 | D. | 乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CO | H2 | CH3OH |
| 浓度(mol•L-1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com