
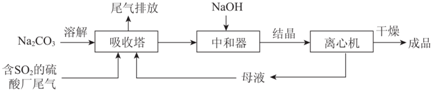
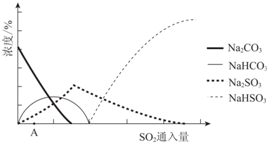
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3•7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3•7H2O在空气中易被氧化. |
分析 Na2SO3应用广泛.利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3,吸收塔中发生的反应为2CO32-+SO2+H2O=2HCO3-+SO32-,为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的,加入氢氧化钠进入中和器得到溶液结晶进入离心机干燥得到晶体,滤液重新进入吸收塔循环使用,
(1)二氧化硫会导致酸雨;
(2)由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠;
(3)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠;
(4)①Na2SO3溶解电离出钠离子,NaOH过量使c(Na+)增大,抑制Na2SO3溶解;
②由于冷却至33℃以下时析出Na2SO3•7H2O,应在较高温度下蒸发浓缩至有大量晶体析出,利用余热蒸发;
(5)用盐酸除去亚硫酸钠,再用氯化钡溶液检验硫酸根离子;
(6)①IO3-与SO32-发生氧化还原反应得到SO42-与I-,I元素化合价降低6价,S元素化合价升高2价,化合价升降最小公倍数为6,可得IO3-的系数为1、SO32-的系数为3,再结合原子守恒、电荷守恒配平;
②根据离子方程式计算亚硫酸钠的物质的量,进而计算其质量分数.
解答 解:(1)向大气中排放SO2会导致酸雨发生,
故答案为:酸雨;
(2)由图可知,初期反应(图中A点以前)碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应离子方程式为:2CO32-+SO2+H2O=2HCO3-+SO32-,
故答案为:2CO32-+SO2+H2O=2HCO3-+SO32-;
(3)随着二氧化硫通入量增大,后期生成主要是得到亚硫酸氢钠,中和器中主要是将亚硫酸氢钠转化为硫酸钠,同时碳酸氢钠反应得到碳酸钠,主要反应化学方程式为:NaHSO3+NaOH=Na2SO3+H2O,
故答案为:NaHSO3+NaOH=Na2SO3+H2O;
(4)①Na2SO3存在溶解平衡:Na2SO3(s)?2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动,抑制Na2SO3溶解,
故答案为:Na2SO3存在溶解平衡:Na2SO3(s)?2Na+ (aq)+SO32- (aq),NaOH过量使c(Na+)增大,上述平衡逆向移动;
②a.加热蒸发直至蒸干,容易使固体溅出,导致损失等,故a错误
B.维持95~100℃蒸发浓缩至有大量晶体析出,再利用余热蒸干,故B正确;
C.由于冷却至33℃以下时析出Na2SO3•7H2O,应在较高温度下蒸发浓缩结晶,故C错误,
故答案为:B;
(5)用盐酸除去亚硫酸钠,防止干扰,再用氯化钡溶液检验硫酸根离子,
故答案为:稀盐酸;BaCl2溶液;
(6)①IO3-与SO32-发生氧化还原反应得到SO42-与I-,I元素化合价降低6价,S元素化合价升高2价,化合价升降最小公倍数为6,可得IO3-的系数为1、SO32-的系数为3,配平后离子方程式为:IO3-+3SO32-=3SO42-+I-,
故答案为:1;3;3SO42-;1I-;
②消耗KIO3的物质的量为y×10-3L×x mol/L=xy×10-3mol,
由IO3-+3SO32-=3SO42-+I-,可知n(Na2SO3)=3n(KIO3)=3xy×10-3mol
则成品中Na2SO3的质量分数为$\frac{3xy×1{0}^{-3}mol×126g/mol}{0.126g}$×100%=3xy×100%,
故答案为:3xy×100%.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定、实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础.


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
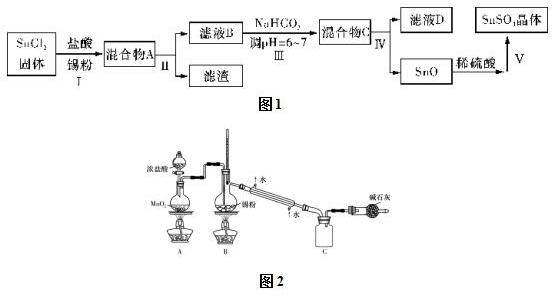
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
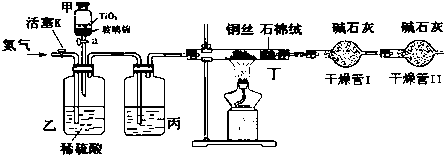
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
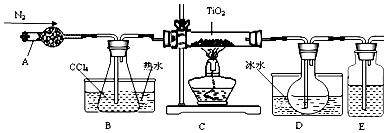
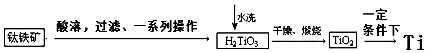
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com