
 利用如图装置可验证同主族元素非金属性的变化规律.
利用如图装置可验证同主族元素非金属性的变化规律.分析 (1)仪器D为干燥管;
(2)A盛放浓盐酸,B盛放高锰酸钾,AB为氯气的发生装置,C为氯气与淀粉碘化钾混合溶液反应装置,D为防倒吸装置,缺少尾气处理装置.氯气具有强氧化性,能将碘离子氧化为碘单质,碘遇淀粉试液变蓝色;氯气有毒,不能直接排空,可以用NaOH溶液吸收;
(3)盐酸挥发,应排除实验中干扰,盐酸酸性强于碳酸,二氧化碳能使石灰水变浑浊,非金属性强弱利用非金属性最高价氧化物对应水化物的酸性强弱来判断非金属性强弱.
解答 解:(1)仪器D的名称是球形干燥管,能够防止倒吸,可以避免C中液体进入锥形瓶中,
故答案为:球形干燥管;
(2)KMnO4与浓盐酸反应生成氯气,2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,氯气与淀粉碘化钾混合溶液反应生成碘单质,反应离子方程式为2I-+Cl2═I2+2Cl-,碘遇淀粉试液变蓝色,故C中溶液变为蓝色;过量的氯气会逸散到空气中,污染环境,可用NaOH溶液吸收,反应离子方程式为:2OH-+Cl2═Cl-+ClO-+H2O,
故答案为:变蓝;NaOH;
(3)因碳酸比硅酸强,二氧化碳可与硅酸钠反应生成硅酸沉淀,溶液变浑浊,氯化氢具有挥发性,干扰实验结果,需要将二氧化碳中的氯化氢除掉,根据氯化氢与碳酸氢钠反应,而二氧化碳不反应,可以在B和C之间增加装有饱和NaHCO3溶液的洗气瓶,C中发生的化学反应能够证明非金属性强弱(C>Si)的理论依据是:非金属性最高价氧化物对应水化物的酸性强弱,酸性越强对应非金属性越强,碳酸酸性大于硅酸说明碳比硅活泼,
故答案为:饱和NaHCO3;有白色沉淀生成;非金属性最高价氧化物对应水化物的酸性强弱,酸性越强对应非金属性越强,碳酸酸性大于硅酸说明碳比硅活泼.
点评 本题考查了探究金属单质的金属性强弱、非金属单质的非金属性强弱方法、实验方案设计,正确掌握判断金属性、非金属性强弱的方法,明确物质的性质是解本题关键,考查了学生灵活运用知识解答问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硫酸、浓硝酸共热并保持55~60℃反应生成硝基苯 | |
| B. | 甲苯与氯气在光照的条件下反应主要生成2,4-二氯甲苯 | |
| C. | 苯酚与浓溴水反应生成2,4,6-三溴苯酚 | |
| D. | 丙烯与溴的四氯化碳溶液反应生成1,2-二溴丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 随原子序数递增,元素原子的最外层电子排布呈现周期性变化 | |
| B. | 随原子序数递增,元素的原子半径呈现由大到小的周期性变化(惰性气体除外) | |
| C. | 随原子序数递增,元素的最高化合价重复出现从+1〜+7、最低化合价从-7〜-1的变化 | |
| D. | 随原子序数递增,元素的金属性和非金属性呈现周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内H2O(g)、CO、H2物质的量相等 | B. | 容器内气体的密度不再改变 | ||
| C. | 生成n mol CO的同时生成n mol H2 | D. | v正(H2O)=v正(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
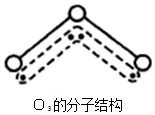 1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
1994年度诺贝尔化学奖授予为研究臭氧作出特殊贡献的化学家.O3能吸收有害紫外线,保护人类赖以生存的空间.O3分子的结构如图,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中必含离子键 | D. | 共价化合物中不含离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com