
已知温度T0C时水的离子积常数为Kw,该温度下,将浓度为a mol·L-1的一元酸HA与
b mol·L-1的一元碱BOH等体积混合,可判定该混合液呈中性的依据是( )
A.a=b
B.混合溶液的pH=7
C.混合溶液中,c(H+)=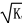 mol·L-1
mol·L-1
D.混合溶液中,c(H+)+c(B+)=c(OH-)+c(A-)
科目:高中化学 来源:2016-2017学年河北省高二12月月考化学卷(解析版) 题型:选择题
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g)ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋
MgO(s)+CO2(g)+SO2(g)ΔH>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋 势合理的是
势合理的是

查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
已知1 mol CH4气体完全燃烧生成气态CO2和液态H2O,放出890.3 kJ热量,表示该反应的热化学方程式正确的是
A.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(g) ΔH=+890.3 kJ·molˉ1
B.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(l) ΔH=-890.3 kJ·molˉ1
C.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(l) ΔH=+890.3 kJ·molˉ1
D.CH4 (g)+2O2 (g)=CO2 (g)+2H2O(g) ΔH=-890.3 kJ·molˉ1
查看答案和解析>>
科目:高中化学 来源:2017届浙江省“七彩阳光”新高考研究联盟高三上考试化学试卷(解析版) 题型:选择题
下列化合物中,属于碱的是
A.MgO B.SO2 C.H2SO4 D.Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期中质检化学试卷(解析版) 题型:选择题
用下表提供的仪器和药品,能完成实验目的的是 ( )
| 仪器 | 药品 | 实验目的 |
A | 烧杯、分液漏斗、 | 待提纯AlCl3溶液、NaOH溶液 | 除去AlCl3溶液中的 |
B | 分液漏斗、烧瓶、 | 盐酸、大理石、 | 证明非金属性: |
C | 酸式滴定管、锥形瓶、 | 已知浓度的盐酸、 | 测定NaOH溶液的浓度 |
D | 胶头滴管、试管 | Na2CO3溶液、稀盐酸 | 鉴别Na2CO3溶液、稀盐酸 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期中质检化学试卷(解析版) 题型:选择题
研究发现空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO,②SO3+H2O→H2SO4,③2NO+O2→2NO2。
NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是( )
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.浓H2SO4滴入萤石(CaF2)中加热生成HF
C.木材棍插入浓H2SO4中变黑
D.淀粉溶液加入稀H2SO4并加热转化为葡萄糖
查看答案和解析>>
科目:高中化学 来源:2017届湖南省怀化市高三上学期期中质检化学试卷(解析版) 题型:选择题
下列说法中正确的是 ( )
A. 从海水中提取多种化学物质都发生了化学变化
B. 可用盛有浓氨水的“喷枪”检验输送氯气的管道是否漏气
C. 铁是人体必需的微量元素,要多食富含Fe3+的食物或服用含Fe3+的药剂
D. 有胃溃疡的病人也可服用小苏打药片治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上第五次调研化学卷(解析版) 题型:填空题
氮的化合物在生产生活中广泛存在。
(1)①可通过反应:NH3(g)+ Cl2(g)=NH2Cl(g)+ HCl(g)制备氯胺,己知部分化学键的键能:
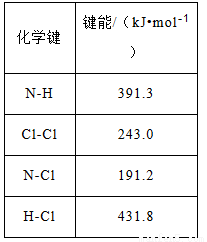
则上述反应的△H=______________。
② NH2Cl与水反应生成强氧化性的物质,可作长效缓释消毒剂,该反应的化学方程式为:_________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)  N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t 的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400 ℃、400 ℃、T ℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t 的变化情况如下表所示:
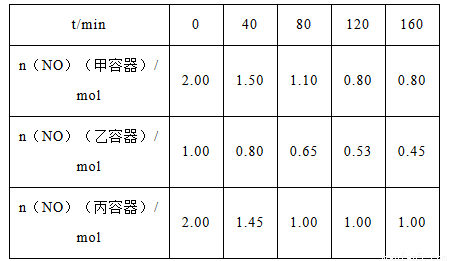
①该反应为________(填“放热”或“吸热”)反应
②乙容器在200min达到平衡状态,则0~200 min内用NO的浓度变化表示的平均反应速率v(NO)=_________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
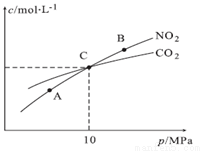
A、B两点的浓度平衡常数关系:Kc(A)________Kc(B)(填“< ”或“> ”或“=”)。
A、B、C三点中NO2的转化率最高的是:__________(填“A”或“B”或“C”)点.
计算C点时该反应的压强平衡常数:Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二12月模拟二化学卷(解析版) 题型:推断题
在下图所示的物质转化中,A、C均为常见的金属单质, 并且在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物;X为常见无色液体;L的焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)。
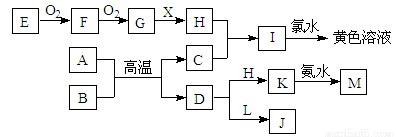
回答以下问题:
(1)H的化学式为 。
(2)L的电子式为 。
(3)A与B反应的化学方程式为 。
(4)K与足量的氨水反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com