
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
| A、ⅦA族元素 | B、聚乙烯 |
| C、ⅠA族元素 | D、二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ||||||||
| ② | ③ | ④ | ⑤ | |||||
| ⑥ | ⑦ | ⑧ | ⑨ | |||||
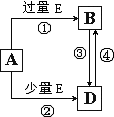
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 300 | 400 | 500 | 750 | 1000 |
| 平衡常数 | 1.8 | 1.6 | 1.0 | 0.8 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 为提高人体素质,避免人体缺碘影响正常的生命活动,我国早已 采取食盐加碘措施.据报道,人从食物中摄取碘后碘便在甲状腺中积存下来,通过一系列化学反应可形成甲状腺素.甲状腺素的结构如图,回答下列问题:
为提高人体素质,避免人体缺碘影响正常的生命活动,我国早已 采取食盐加碘措施.据报道,人从食物中摄取碘后碘便在甲状腺中积存下来,通过一系列化学反应可形成甲状腺素.甲状腺素的结构如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | ① | ② | ||||||
| 二 | ③ | ④ | ⑤ | ⑥ | ⑦ | |||
| 三 | ⑧ | ⑨ | ⑩ | (11) | ||||
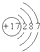 所表示的原子是
所表示的原子是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaOH+HCl=NaCl+H2O |
| B、2Na+2H2O=2NaOH+H2↑ |
| C、CaCO3+2HCl=CaCl2+H2O+CO2↑ |
| D、CO2+2NaOH=Na2CO3+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com