
| A. | 芳香烃都符合通式CnH2n-6(n≥6) | B. | 分子中含苯环的化合物都是芳香烃 | ||
| C. | 芳香烃都有香味,因此得名 | D. | 芳香烃属于芳香族化合物 |
分析 A.苯及同系物的通式CnH2n-6(n≥6);
B.含苯环的化合物属于芳香化合物;
C.早期发现的这类化合物多有芳香味道,所以称这些烃类为芳香烃;
D.芳香烃属于芳香族化合物.
解答 解:A.苯及同系物的通式CnH2n-6(n≥6),苯的同系物含有1个苯环,侧链为烷基,含苯环的烃为芳香烃,芳香烃不一定含有1个苯环,侧链不一定为烷基,故通式不一定符合此通式,故A错误;
B.含有苯环的物质一定属于芳香化合物,而不是芳香烃,故B错误;
C.早期发现的这类化合物多有芳香味道,并不是所有的芳香烃都有香味,故C错误;
D.芳香烃属于芳香族化合物,故D正确,
故选D.
点评 本题考查了芳香烃的相关知识,明确芳香烃的概念及由来是解题的关键,本题难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②④⑤ | C. | ②③④⑤ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
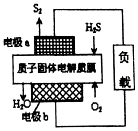
| A. | 电极a为电池的负极 | |
| B. | 电极b上发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 若电路中通过2mol电子,则电池内部释放632kJ热量 | |
| D. | 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

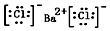 .
.| AgCl | AgI | Ag2CrO4 | |
| Ksp | 2×10-10 | 8.3×10-17 | 2×10-12 |
| 颜色 | 白 | 黄 | 砖红 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
| Ksp | 1.0×10-33 | 4.0×10-38 | 2.0×10-20 | 4.0×10-14 |
 ;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.
;“净化”时,加入(NH4)2S的作用为使Cu2+转化为CuS沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
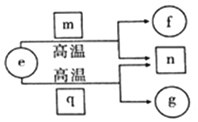 短周期元素X、Y、Z、W的原子序数依次增加,且Y、W为同主族元素.e、f、g分别是元素 Y、X、W的单质;m、n、q分别是由元素X、Y、W与元素Z组成的二元化合物,常温下的 状态依次为液态、气态、固态.上述物质的转化关系如图所示.下列说法错误的是( )
短周期元素X、Y、Z、W的原子序数依次增加,且Y、W为同主族元素.e、f、g分别是元素 Y、X、W的单质;m、n、q分别是由元素X、Y、W与元素Z组成的二元化合物,常温下的 状态依次为液态、气态、固态.上述物质的转化关系如图所示.下列说法错误的是( )| A. | 原子半径的大小:W>Z>X | |
| B. | 简单氢化物的沸点:W>Y>Z | |
| C. | 元素Y、Z、W形成的单质不止一种 | |
| D. | 元素Y、Z、W与元素X均能形成18e-的分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com