
【题目】某有机物的结构简式见如图,取足量的Na、NaOH(aq)和NaHCO3(aq)分别和等物质的量的该物质在一定条件下反应(必要时可以加热),完全反应后消耗的Na、NaOH和NaHCO3三种物质的物质的量之比是
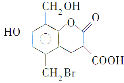
A.3∶4∶2B.3∶5∶1C.3∶5∶2D.3∶4∶1
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。
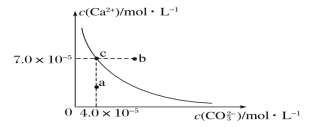
(1)通过蒸发,可使稀溶液由_______点变化到_______点。
(2)在25℃时,反应CaSO4(s)+CO32- (aq)CaCO3(s)+SO42-(aq)的平衡常数K_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合草酸晶体的组成可表示为![]() ,为测定x的值,做了如下实验:
,为测定x的值,做了如下实验:
![]() 称取Wg纯草酸晶体,将其配制成100mL水溶液为待测液;
称取Wg纯草酸晶体,将其配制成100mL水溶液为待测液;
![]() 取25mL待测液放入锥形瓶中,再加入适量的稀
取25mL待测液放入锥形瓶中,再加入适量的稀![]() ;
;
![]() 用浓度为a
用浓度为a![]() 的
的![]() 标准溶液进行滴定
标准溶液进行滴定![]() 滴定过程中有
滴定过程中有![]() 、
、![]() 生成
生成![]() 。
。
请回答:(1)写出滴定时发生的反应的离子方程式为:______。
(2)滴定时,将![]() 标准液装在 ______ 式滴定管中。
标准液装在 ______ 式滴定管中。
(3)假设滴定终点时,用去VmL![]() 溶液,则待测草酸溶液的物质的量浓度为 ______
溶液,则待测草酸溶液的物质的量浓度为 ______ ![]() 。
。
(4)在上述实验中,下列操作![]() 其他操作正确
其他操作正确![]() 会造成测定结果x值偏高的有 ______
会造成测定结果x值偏高的有 ______ ![]() 填字母
填字母![]() 。
。
A.滴定终点读数时俯视读数![]() 酸式滴定管使用前,水洗后未用标准液润洗
酸式滴定管使用前,水洗后未用标准液润洗
C.锥形瓶水洗后再用待测液润洗![]() 滴定时所用的
滴定时所用的![]() 溶液因久置而导致浓度变小。
溶液因久置而导致浓度变小。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】”生活无处不化学”.下列关于生活中的问题解释不合理的是
A.食盐不慎洒落在 天然气的火焰上,观察到黄色火焰,其原因:2Na+O2![]() Na2O2
Na2O2
B.沾水的铁制品器皿高温灼烧会发黑,其可能原因:3Fe+4H2O![]() Fe3O4+4H2
Fe3O4+4H2
C.Al(OH)3可用于中和过多的胃酸,其原因:Al(OH)3+3HCl=AlCl3+3H2O
D.明矾可以净水,是因为明矾[KAl(SO4)2·H2O]溶于水能生成Al(OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在1 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A.反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B.反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C.10 s后,该反应停止进行
D.反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚乙酯是一种重要的添加剂,其结构简式为![]() 。用环氧乙烷合成碳酸亚乙酯的反应为:
。用环氧乙烷合成碳酸亚乙酯的反应为:![]() 。下列说法错误的是
。下列说法错误的是
A.上述反应属于加成反应
B.碳酸亚乙酯的二氯代物只有两种
C.碳酸亚乙酯中的所有原子处于同一平面内
D.1mol碳酸亚乙酯最多可消耗2molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种物质且焰色反应都呈黄色,A为单质,B为淡黄色粉末,A、B 与水反应都有C生成,C与过量的CO2反应生成E,E加热能生成D。试推断:
(1) B_____,C_____,D___,E____ 。(写化学式)
(2)写出有关反应的化学方程式。
①A和水反应:____ 。
②C和过量的CO2反应:____
③E受热分解的反应:____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式______________。
(2)写出NaClO3发生反应的主要离子方程式______________;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_____________。
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为___________。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是__________________。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取剂的目的是_________;其使用的最佳pH范围是________________。

A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是________________。(答一条即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com