
【题目】回收的废旧锌锰干电池经过处理后可得到锰粉(含MnO2、Mn(OH)2、Fe和炭粉等),由锰粉为主要原料制备高性能磁性材料碳酸锰(MnCO3)的工艺流程如下:
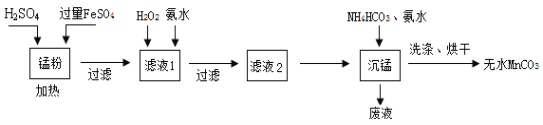
已知:①2H2SO4 + MnO2 + 2FeSO4 = MnSO4 + Fe2(SO4)3 + 2H2O
②部分氢氧化物的Ksp(近似值)如下表(25 ℃)
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp | 10-13 | 10-17 | 10-38 |
根据上图流程及有关数据回答下列问题。
(1)锰粉酸溶时,过量FeSO4所起的作用为______________________。
(2)往滤液1中先加入H2O2的目的是氧化Fe2+,该反应的离子方程式为________________,后加入氨水的目的是调节pH除去杂质离子,使滤液中的杂质离子沉淀完全(残留在溶液中的离子浓度≤ l0-5 mol·L-1),常温下测得溶液中c(Mn2+)=0.1 mol·L-1,则需调节溶液的pH范围为_______________。
(3)沉锰工序中,加入氨水的目的是(从化学平衡移动的角度解释)___________,沉锰工序中判断沉淀已经洗涤干净的实验操作是________________________________。
(4)沉锰后废液中的主要成份为_____________________________。
【答案】把二氧化锰完全转化成二价锰离子 2Fe2++H202+2H+= 2Fe3++2H2O 38 促进HCO3-离子的电离,提供出CO32-来沉锰 取最后一次洗涤液少许于试管中,向其中滴加稀盐酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成,若不产生白色沉淀表明沉淀已经洗净 硫酸铵和氨水
【解析】
(1)根据提供的方程式可以看出FeSO4作用为把二氧化锰完全转化成二价锰离子;
(2)氧化还原反应方程式书写注意考虑溶液的酸碱性;pH计算要两步,不能让Mn2+
沉淀而且要让三价铁完全沉淀;
(3)碱性来促进HCO3-离子的电离,提供出CO32-来沉锰,溶液中主要有硫酸根离子,可根据其离子的沉淀法来考虑是否涤干净;
(4)根据守恒不难发现其成分主要为硫酸铵和过量氨水。
(1)根据提供的方程式可以看出FeSO4作用为把二氧化锰完全转化成二价锰离子,故答案为:把二氧化锰完全转化成二价锰离子;
(2)往滤液1中先加入H2O2将Fe2+氧化成Fe3+,该反应的离子方程式为: 2Fe2++H202+2H+= 2Fe3++2H2O;后加入氨水调节pH使Fe3+转化为Fe(OH)3沉淀而除去,根据Ksp[Fe(OH)3]=10-38,Fe3+完全沉淀时得:c(OH-)=![]() =10-11mol/L,c(H+)=1×10-3mol/L,Fe3+沉淀完全时溶液的pH=3;不能让Mn2+沉淀,则根据Mn(OH)2的溶度积常数得:Ksp[Mn(OH)2]=c(Mn2+) c2(OH-)=0.1 mol·L-1×c2(OH-)=10-13,c(OH-)=
=10-11mol/L,c(H+)=1×10-3mol/L,Fe3+沉淀完全时溶液的pH=3;不能让Mn2+沉淀,则根据Mn(OH)2的溶度积常数得:Ksp[Mn(OH)2]=c(Mn2+) c2(OH-)=0.1 mol·L-1×c2(OH-)=10-13,c(OH-)=![]() =10-6mol/L,c(H+)=1×10-8mol/L,Mn2+开始沉淀时溶液的pH=8,所以需调节溶液的pH范围为38,
=10-6mol/L,c(H+)=1×10-8mol/L,Mn2+开始沉淀时溶液的pH=8,所以需调节溶液的pH范围为38,
故答案为:2Fe2++H202+2H+= 2Fe3++2H2O;38;
(3)根据流程图,沉锰工序中,加入碳酸氢铵和氨水生成碳酸锰,所以加氨水的目促进HCO3- 离子的电离,提供出CO32-来沉锰;溶液中含有硫酸根,所以可以根据是否存在硫酸根离子来判断沉淀是否洗涤干净,实验操作为:取最后一次洗涤液少许于试管中,向其中滴加稀盐酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成,若不产生白色沉淀表明沉淀已经洗净;
故答案为:促进HCO3-离子的电离,提供出CO32-来沉锰;取最后一次洗涤液少许于试管中,向其中滴加稀盐酸酸化,再滴加氯化钡溶液,观察是否有白色沉淀生成,若不产生白色沉淀表明沉淀已经洗净;
(4)根据流程图知,刚开始加入了硫酸溶液和FeSO4,后来加入过量氨水,结合各阶段的反应,所以废液中的主要成份为硫酸铵和氨水,
故答案为:硫酸铵和氨水。


科目:高中化学 来源: 题型:
【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体混合物X可能由Ba(OH)2、NaOH、Na2CO3、KCl、K2SO4中的几种物质混合而成。取适量样品进行如下实验(假设各反应物都充分反应),根据实验现象和实验数据,下列说法不正确的是( )

A.沉淀甲中有1.97gBaCO3
B.固体混合物X中一定有Ba(OH)2、Na2CO3、K2SO4
C.根据上述实验现象无法确定固体混合物X中是否有NaOH
D.用铂丝蘸取溶液甲在酒精灯火焰上灼烧,通过蓝色钴玻璃观察焰色,即可判断X中有无KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ/mol
2H2(g)+O2(g)═2H2O(g) △H=484 kJ/mol
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g)![]() CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
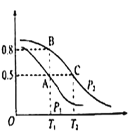
①A、B两点对应的压强大小关系是PA________PB(填“>”,“<”,“=”)
②A、B、C三点的平衡常数KA、KB、KC的大小关系是 ___________
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(3)在P1压强、T1℃时,该反应的平衡常数K=_________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大”、“不变”或“减小”)
(4)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol H2:0.2mol CH3OH:0.2mol。此时v正 ________ v逆(填>、< 或 =)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里常用Na2O2与H2O反应快速制取少量的O2,下面装置用来制取O2并演示Na在O2中的燃烧实验。
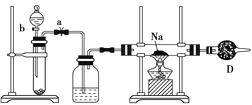
A B C
(1)关闭装置中的止水夹a后,开启活塞b,漏斗中液体不断地往下滴,直至全部流入试管。试判断装置是否漏气________(填“漏气”“不漏气”或“无法确定”),判断理由是__________________________。
(2)写出A装置中反应的化学方程式_______________________。
(3)B装置中盛放的试剂是____________,其作用是________________;
D装置中盛放的试剂是_______,作用是_________________________。
(4)C装置中观察到的现象是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关装置图的叙述中正确的是

A. 用装置①给铜镀银,则b极为单质银,电解质溶液为AgNO3溶液
B. 装置②的总反应式:Cu + 2Fe3+ = Cu2+ + 2Fe2+
C. 装置③中钢闸门应与电源的负极相连被保护,该方法叫做外加电流的阴极保护法
D. 装置④中插入海水中的铁棒,越靠近底端腐蚀越严重
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A+3B![]() 2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
A.用B表示的反应速率是0.75a mol/(L·min)
B.反应开始时,c(B)=3amol·L-1
C.反应2min后,c(A)=0.5amol·L-1
D.反应2min后,c(B)=1.5amol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。试回答下列问题:
CO2(g)+H2(g) △H<0。试回答下列问题:
(1)若起始时c(CO)=2mol·L—1,c(H2O)=3mol·L—1,达到平衡时CO的转化率为60%,则平衡常数K=_____________,此时水蒸气的转化率为______________。
(2)在相同温度下,若起始时c(CO)=1mol·L—1,c(H2O)=2mol·L—1,反应进行一段时间后,测得H2的浓度为0.5mol·L—1,则此时该反应是否达到平衡状态_____(填“是”或“否”),此时v(正)__v(逆)(填“>”“<”或“=”)。
(3)若降低温度,该反应的K值将___________,化学反应速率将______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com