
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
分析 本题探究的是利用CaO2制备过氧化氢,并利用滴定原理测定CaO2含的纯度,涉及滴定操作的实验流程设计,包括指示剂选择淀粉溶液和滴定终点的判断,制备过氧化氢时要关注它的不稳定性,因此要控制温度,另外还有反应原理的分析,相对较易;
(1)根据双氧水不稳定及该反应为放热反应分析;
(2)硫酸钙为微溶物,生成的硫酸钙会覆盖在过氧化钙表明,乙烯测定结果;
(3)双氧水在酸性条件下能够氧化碘离子,据此写出反应的离子方程式;
(4)淀粉遇到碘单质显示蓝色,需要加入淀粉作指示剂;当恰好反应时淀粉消失,溶液变为无色,据此判断滴定终点.
解答 解:(1)根据反应Ca(OH)2(s)+H2O2(aq)=CaO2+2H2O(l)△H<0可知,该反应为放热反应,双氧水浓度升高,则反应速率加快,反应放出的热量增大,导致双氧水分解,所以H2O2浓度大于20%后CaO2产率反而减小,
故答案为:H2O2浓度高,反应速率快,反应放热使体系温度迅速升高,加快H2O2发生分解;
(2)若用稀硫酸,稀硫酸与钙离子反应生成微溶物硫酸钙覆盖在过氧化钙表面,使结果不准确,所以不能用稀硫酸,可以用稀盐酸,故答案为:生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确;
(3)加入KI溶液后,双氧水将碘离子氧化成碘单质,反应的离子方程式为:H2O2+2I-+2H+═I2+2H2O,故答案为:H2O2+2I-+2H+═I2+2H2O;
(4)碘单质遇到淀粉会显示蓝色,当用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入淀粉作滴定的指示剂,用硫代硫酸钠标准溶液继续滴定;滴定结束前溶液为蓝色,反应结束后溶液为无色,则滴定终点的现象为:溶液的蓝色恰好消失且半分钟内颜色不变,故答案为:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
点评 本题考查了探究物质组成、含量的方法,题目难度中等,明确实验原理为解答关键,注意掌握化学实验基本操作方法,明确中和滴定原理,能够正确选用指示剂用和滴定终点,试题培养了学生的分析能力及化学实验能力.


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 钢铁插入水中,水下部分比空气与水交界处更容易腐蚀 | |
| B. | 钢铁在海水中比在河水中更易腐蚀,主要是由于海水中有大量电解质 | |
| C. | 钢铁设备上连接铜块可以防止钢铁腐蚀 | |
| D. | 钢铁设备与外加直流电源的正极相连可以防止钢铁腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3和NaHCO3溶液中离子种类相同 | |
| B. | 在溶质物质的量浓度和体积相等的Na2A和NaHA溶液中,阴离子总数相等 | |
| C. | 在NaHCO3溶液中一定有:c(Na+)+c(H+)═c(HCO3-)+c(OH-)+2 c(CO32-) | |
| D. | 在Na2CO3溶液中一定有:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
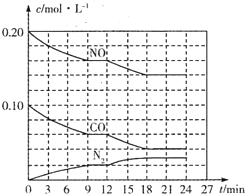 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NA个N2分子和NA个CO2原子个数比为1:1 | |
| B. | 1 mol H2O的质量与NA个H2O质量的总和几乎相等 | |
| C. | 1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
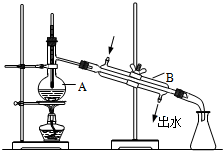 如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.
如图为实验室制取蒸馏水的装置示意图,请根据图示回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com