
| A. | 铜和稀硝酸反应 | B. | 氮气和氧气发生反应 | ||
| C. | 二氧化氮气体溶于水 | D. | 氨的催化氧化 |
科目:高中化学 来源: 题型:解答题
| A | 1使溴的四氯化碳溶液褪色;②比例模型为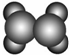 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为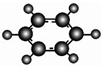 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为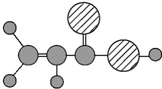 |
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=+817.63 kJ•mol-1 | |
| B. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-641.63 kJ•mol-1 | |
| C. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(l);△H=-641.63 kJ•mol-1 | |
| D. | N2H4(g)+2H2O2(l)═N2(g)+4H2O(g);△H=-817.63 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 滴定时,左手控制滴定管活塞,右手握持锥形瓶,眼睛注视滴定管中的液面 | |
| D. | 用精密pH试纸测得溶液的pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,K、M层电子数之和等于L层电子数 |
| B | 短周期中金属性最强 |
| C | 常温下单质为双原子分子,氢化物的水溶液呈碱性 |
| D | 元素高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液由溶质和溶剂组成,所以每种溶液里只有两种物质 | |
| B. | 硫酸钠溶液能导电是因为溶液中含有较多自由移动的离子 | |
| C. | 配置0.09%的生理盐水的一般步骤是计算、称量和溶解 | |
| D. | 在稀释浓硫酸时,一定要把浓硫酸沿器壁慢慢注入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石空间网状结构中,由共价键形成的碳原子环中,最小环为6元碳环 | |
| B. | 氯化钠晶体中,每个Na+周围距离相等的Cl-共有6个 | |
| C. | 氯化铯晶体中,每个Cs+周围紧邻8个Cl- | |
| D. | 干冰晶体中,每个CO2分子周围紧邻8个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com