
| A. | 等物质的量的CH4在反应①、②中转移的电子数不相同 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol | |
| C. | 4NO2(g)+2N2(g)═8NO(g);△H=+586kJ/mol | |
| D. | 若用2.24LCH4把NO2还原为N2,整个过程中转移的电子总数为0.8NA |
分析 A.根据化合价升高数=化合价降低数=转移电子数来回答;
B.气态水转变为液态水要放热;
C.根据反应①②,利用盖斯定律结合热化学方程式系数的意义来回答;
D.没有说明是否是标准状况下,无法计算.
解答 解:A.反应①②转移的电子数=化合价升高数=化合价降低数=8,反应甲烷中C元素的化合价升高8价,转移8个 电子,则转移电子相同,故A错误;
B.因为气态水转变为液态水要放热,所以由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H<-574kJ•mol-1,故B错误;
C.由反应①②,利用盖斯定律,反应4NO2(g)+2N2(g)═8NO(g),可以是(①-②)得到,所以该反应的△H=(-574kJ/mol+1160kJ/mol)=+586kJ/mol,故C正确;
D.没有说明是否是标准状况下,气体的摩尔体积不知道,无法计算甲烷的物质的量,即无法计算转移的电子,故D错误;
故选C.
点评 本题考查学生热化学方程式的含义以及化学方程式、电子转移知识,属于综合知识的考查,难度中等,注意从化合价的角度分析电子转移,侧重于考查学生的分析能力和计算能力.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:填空题
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
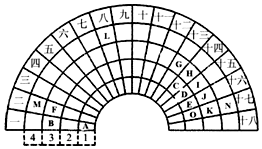 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: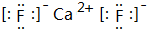 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: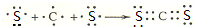 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属铯的密度比金属钠小 | B. | 金属铯的熔点比金属钠高 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com