
【题目】物质结构与性质分钒、砷均属于第四周期元素,最高正价均为+5。
I.高纯度砷可用于生产具有“半导体贵族”之称的新型半导体材料 GaAs,砷与氯气反应可得到 AsCl3、AsCl5两种氯化物。
(1)两种氯化物分子中属于非极性分子的是 ,AsCl3分子的中心原子杂化类型是 ,分 子构型是 。
(2)Ga 与 As 相比,第一电离能较大的元素是 ,GaAs 中砷的化合价为 。研究表明,在 GaAs 晶体中,Ga、As 原子最外电子层均达到 8 电子稳定结构,则 GaAs 的晶体类型是 ,晶体中化学键的键角是 。
II.钒是一种重要的战略金属,其最主要的用途是生产特种钢,其化合价有+5、+4、+3、+2 等,工业上从炼钢获得的富钒炉渣中(内含 V2O5)提取钒的过程如下。
![]()
![]()
(3)基态钒原子的电子排布式为 ,上述钒的几种价态中,最稳定的是 价;写出①、②反应的化学方程式: 、 。
(4)已知单质钒的晶胞为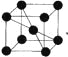 则 V 原子的配位数是 ,假设晶胞的边长为 d cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
则 V 原子的配位数是 ,假设晶胞的边长为 d cm, 密度为 ρ g/cm3,则钒的相对原子质量为 。
【答案】(1) AsCl5;sp3杂化;三角锥型;
(2) As;-3;原子晶体;109°28′;
II.(3) 1s22s22p63s23p63d34s2或[Ar]3d34s2;+5;2V2O5+4NaCl+O2=4NaVO3+2Cl2;V2O5+5Ca=2V+5CaO;
(4) 8;![]() ρd3NA。
ρd3NA。
【解析】试题分析:(1) AsCl3中As的价层电子对数=3+![]() (5-1×3)=4,采用sp3杂化,为三角锥型分子,是极性分子;AsCl5中As的价层电子对数=5+
(5-1×3)=4,采用sp3杂化,为三角锥型分子,是极性分子;AsCl5中As的价层电子对数=5+![]() (5-1×5)=5,为三角双锥型分子,是非极性分子,故答案为:AsCl5;sp3杂化;三角锥型;
(5-1×5)=5,为三角双锥型分子,是非极性分子,故答案为:AsCl5;sp3杂化;三角锥型;
(2) 同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以第一电离能As>Ga,GaAs 中砷的电负性大于镓,所以砷显-3价;由晶体中镓、砷原子最外层电子数目知,镓与砷之间形成了四个共价键(其中有一个为配位键),晶体中每个镓原子、砷原子均与另外四个原子成键,形成空间网状结构的晶体,属于原子晶体,晶体中化学键的键角是109°28′,故答案为:As;-3;原子晶体;109°28′;
II.(3) 钒是23号元素,原子核外电子数为23,基态原子核外电子排布式为:1s22s22p63s23p63d34s2或[Ar]3d34s2,钒的价电子数为5,结合流程图,在钒的几种价态中,最稳定的是+5价。反应①是V2O5在空气中与氯化钠反应生成NaVO3,根据化合价的变化情况,Cl元素化合价升高,生成氯气,反应的方程式为2V2O5+4NaCl+O2=4NaVO3+2Cl2;反应②是V2O5被钙还原生成V,反应的方程式为V2O5+5Ca=2V+5CaO,故答案为:1s22s22p63s23p63d34s2或[Ar]3d34s2;+5;2V2O5+4NaCl+O2=4NaVO3+2Cl2;V2O5+5Ca=2V+5CaO;
(4)根据晶胞图可知,每个矾原子周围距离最近的有8个矾原子,所以矾的配位数为8,每个晶胞中含有的矾原子数为1+8×![]() =2,晶胞的体积为d3cm3,根据ρ=
=2,晶胞的体积为d3cm3,根据ρ=![]() 可知,钒的相对原子质量M=
可知,钒的相对原子质量M=![]() ρVNA=
ρVNA=![]() ρd3NA,故答案为:8;
ρd3NA,故答案为:8;![]() ρd3NA。
ρd3NA。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2SO2(g)+O2(g)![]() 2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是
2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是
A.c(SO2)=0.1mol/L B.c(O2)=0.05mol/L
C.c(SO3)=0.5mol/L D.c(SO2)=0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列4种物质:①NO2、②FeCl3、③Al(OH)3、④浓HNO3.其中,既能与酸反应又能与碱反应生成盐和水的是 (填序号,下同);与水反应产生无色气体的是 ;遇KSCN溶液显红色的是 ;常温下能使铁表面生成致密氧化膜的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)E、F、G三种元素的原子序数依次增大,其原子的最外层电子排布均为4s1.则F元素在其化合物中最高化合价为 .
(2)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于 晶体;基态Ni原子的电子占有 种能量不同的原子轨道.
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.
如①CH2═CH2②CH≡CH③![]() ④
④![]() 等,其中C原子为sp2杂化的分子有 (填序号),预测HCHO分子的立体结构为 形.
等,其中C原子为sp2杂化的分子有 (填序号),预测HCHO分子的立体结构为 形.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.下列有关双酚A的叙述不正确的是( )

A.双酚A的分子式是C15H16O2
B.双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3
C.反应①中,1mol双酚A最多消耗2 mol Br2
D.反应②的产物中只有一种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在 500 mL KNO3 和 Cu(NO3)2 的混合溶液中,c(NO3-) = 6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到 22.4 L 气体(标准状况),假定电解后溶液体积仍为 500 mL,下列说法正确的是
A.电解得到的 Cu 的物质的量为 0.5 mol
B.向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液
C.原混合溶液中 c(K+) = 4 mol/L
D.电解后溶液中 c(H+) = 2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA为阿伏加德罗常数的值)
A.1mol OH-与1mol-OH所含质子数均为9NA
B.pH=1的H2SO4溶液含H+的数目为0.2NA
C.273K,101kPa条件下,14g乙烯与丙烯的混合物中含有的碳原子数目为3NA
D.标准状况下,11.2L CCl4含有C-Cl键的数目为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com