
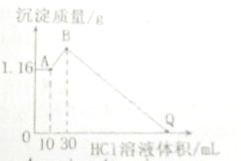
 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浑浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示.请回答
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的浑浊液中逐滴加入1mol?L-1HCl溶液,加入HCl溶液的体积与生成沉淀的质量关系如下图所示.请回答| 1.16g |
| 58g/mol |
| 0.13mol |
| 1mol/L |


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
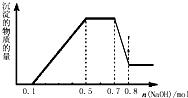 溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( )| A、溶液中一定不含CO32-,可能含有SO42-和NO3- |
| B、在滴加NaOH溶液物质的量为0.5至0.7mol时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
| C、溶液中的阳离子只有H+、Mg2+、Al3+ |
| D、n(H+):n(NH4+):n(Mg2+)=2:4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
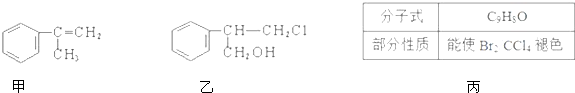
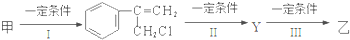
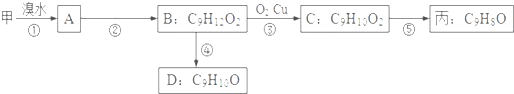
| Br2 |
| CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改变压强能改变气体反应的速率 |
| B、增大浓度能加快化学反应速率,原因是增大浓度就增加了反应体系中活化分子的百分数 |
| C、温度升高使化学反应速率加快的主要原因是增加了反应体系中活化分子的百分数 |
| D、催化剂能加快化学反应速率主要原因是降低反应所需的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
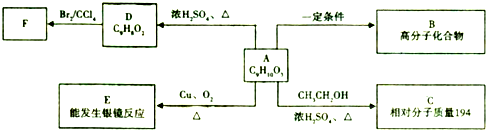
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com