
| m |
| 64 |
| m |
| 44 |
| M |
| Vm |
| V |
| Vm |
| m |
| n |
| V |
| Vm |
| N |
| n |
| m |
| 64 |
| m |
| 44 |
| M |
| Vm |
| 0.448L |
| 22.4L/mol |
| 1.28g |
| 0.02mol |
| 3×2.0×10 |
| 50 |
| WL |
| 22.4L/mol |
| W |
| 22.4 |
| N |
| n |
| x | ||
|
| 22.4x |
| W |
| 22.4x |
| W |
| V |
| Vm |
| 36.5a |
| 22.4 |
| m |
| ρ |
1000g+
| ||
| bg/cm3 |
| 22400+36.5a |
| 22.4b |
| n |
| V |
| 1000ab |
| 22400+36.5a |
| 1000ab |
| 22400+36.5a |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、-317.3 kJ/mol |
| B、-379.3 kJ/mol |
| C、-332.8 kJ/mol |
| D、+317.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是分散质粒子的直径在10-9~10-7m之间 |
| B、胶体分散质的直径介于溶液和浊液分散质直径之间 |
| C、用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D、Fe(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2的摩尔质量是16g |
| B、碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物 |
| C、碳酸钠溶液能使酚酞试液变红,因此它是碱 |
| D、虽然二氧化碳溶于水能导电,但它是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的Na2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| B、常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| C、常温下c(NH4+)相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中,溶质的物质的量浓度大小:①>②>③ |
| D、等体积、等物质的量浓度的NaX和弱酸HX混合后呈酸性的溶液中:c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
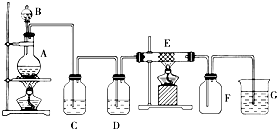 如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.
如图为制取纯净干燥的Cl2并让其与铁发生反应的装置,A是Cl2发生装置,C、D为气体净化装置,E硬质玻璃管中装有细铁丝网;F为干燥的空广口瓶;烧杯G为尾气吸收装置.查看答案和解析>>
科目:高中化学 来源: 题型:

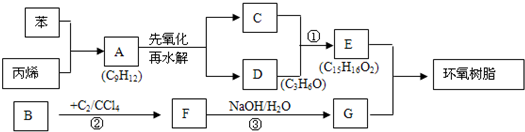
| 1 |
| 2 |
| 催化剂 |
| △ |
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com