
【题目】在N2+3H22NH3的可逆反应中,自反应开始至2s末,氨的浓度由0变为0.8 molL﹣1 则以氢气的浓度变化表示该反应在2s内的平均反应速率是( )
A.0.3 molL﹣1S﹣1
B.0.4 molL﹣1S﹣1
C.0.6molL﹣1S﹣1
D.0.8 molL﹣1S﹣1
 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:分析图像,以下结论错误的是
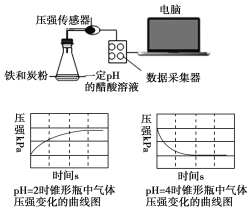
A.溶液pH≤2时,生铁发生析氢腐蚀
B.在酸性溶液中生铁可能发生吸氧腐蚀
C.析氢腐蚀和吸氧腐蚀的速率一样快
D.两溶液中负极反应均为:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在生产生活中应用十分广泛。请回答下列问题:
(1)通过SO2传感器可监测大气中SO2的含量,其工作原理如图所示。
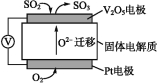
①固体电解质中O2向 (填“正”或“负”)极移动。
②写出V2O5电极的电极反应式: 。
(2)如图所示装置(Ⅰ)是一种可充电电池,装置(Ⅱ)是一种以石墨为电极的家用环保型消毒液发生器。装置(Ⅰ)中离子交换膜只允许Na+通过,充、放电的化学方程式为2Na2S2+NaBr3![]() Na2S4+3NaBr。
Na2S4+3NaBr。
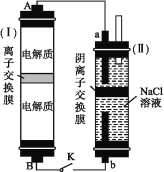
①负极区的电解质为 (用化学式表示)。
②家用环保型消毒液发生器发生反应的离子方程式为 。
③闭合开关K,当有0.04 mol Na+通过离子交换膜时,a电极上析出的气体在标准状况下的体积为
mL。
(3)下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40% NaOH溶液,发现电流表指针都发生偏转。
+I2+H2O”设计成的原电池装置,其中C1、C2、C3、C4均为碳棒。甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸或40% NaOH溶液,电流表指针都不发生偏转;乙组经思考后先添加了一种离子交换膜,然后向图Ⅱ烧杯右侧中逐滴加入适量浓盐酸或适量40% NaOH溶液,发现电流表指针都发生偏转。
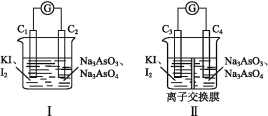
①甲组电流表指针都不发生偏转的原因是 。
②乙组添加的是 (填“阴”或“阳”)离子交换膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml浓H2SO4溶液(足量)中加入3.2g Cu,在加热条件下充分反应:
(1)反应消耗的H2SO4的物质的量是 , 生成SO2的体积为(标准状况下)mL.
(2)若题干中浓硫酸的物质的量浓度为a molL﹣1 , 投入足量的铜片加热,充分反应后,被还原的硫酸的物质的量n(H2SO4)0.025a mol(填“等于”、“大于”或“小于”).
(3)将题干中反应后的溶液稀释到500mL,取出50mL,并向取出液中加入足量的BaCl2溶液,得到沉淀19.81g,求原浓硫酸的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用乙醇与浓硫酸的混合液在加热的条件下可以发生消去反应,某实验小组的同学在实验室用如下图所示装置验证消去反应的产物。(气密性已检验,部分夹持装置略)。

实验操作和选项:
操作 | 现象 |
点燃酒精灯加热至 | Ⅰ: Ⅱ: |
…… | |
实验完毕,清洗烧瓶 | Ⅲ: |
(1)烧瓶内发生的有机反应化学方程式是____________________________________,烧瓶内产生刺激性气味的气体的无机反应化学方程式是____________________________________。
(2)溶液“渐渐变黑”说明浓硫酸具有_________性。
(3)甲同学认为若![]() 中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使
中溶液褪色,即可证明烧瓶中发生了消去反应,根据甲同学的观点,使![]() 中溶液褪色反应的化学方程式是____________________________________。
中溶液褪色反应的化学方程式是____________________________________。
(4)乙同学却认为即使![]() 中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在
中溶液褪色,也不能证明烧瓶中发生了消去反应。于是提出了两种改进方案①在![]() 、
、![]() 间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
间增加一个装有某种试剂的洗气瓶,该试剂为___________________________________。
②在![]() 、
、![]() 间增加一个盛有浓硫酸的洗气瓶,并将
间增加一个盛有浓硫酸的洗气瓶,并将![]() 中的
中的![]() 的水溶液改为
的水溶液改为![]() 的
的![]() 溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
溶液,即可排除干扰,据实验现象可证明烧瓶中发生了消去反应。
则乙同学认为![]() 中使
中使![]() 的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使
的水溶液褪色,产生干扰的原因(用化学方程式解释)_________,由方案②可知___________ 不能使![]() 的四氯化碳溶液褪色。
的四氯化碳溶液褪色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:碱存在下,卤代烃与醇反应生成醚(![]() ):
):
![]()
化合物![]() 经下列四步反应可得常用溶剂四氢呋喃,反应框图如下:
经下列四步反应可得常用溶剂四氢呋喃,反应框图如下:

![]() 、
、![]() 互为同分异构体,请回答下列问题:
互为同分异构体,请回答下列问题:
(1)![]() 和
和![]()
![]() 在一定条件下恰好反应,生成饱和一元醇
在一定条件下恰好反应,生成饱和一元醇![]() ,
, ![]() 的分子式为
的分子式为![]() ,
, ![]() 的结构简式为_________________。
的结构简式为_________________。
(2)第①③步反应类型分别为_______________反应,③_______________反应。
(3)化合物![]() 具有的化学性质(填写字母代号)是_______________。
具有的化学性质(填写字母代号)是_______________。
![]() 、可发生催化氧化反应
、可发生催化氧化反应
![]() 、与浓硫酸共热或与氢氧化钠的醇溶液共热均能发生消去反应
、与浓硫酸共热或与氢氧化钠的醇溶液共热均能发生消去反应
![]() 、可发生酯化反应
、可发生酯化反应
![]() 、催化条件下可发生加聚反应
、催化条件下可发生加聚反应
(4)核磁共振氢谱显示![]() 分子中有两种氢,写出
分子中有两种氢,写出![]() 的化学反应方程式:_______________。
的化学反应方程式:_______________。
(5)四氢呋喃(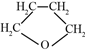 )有多种同分异构体,写出符合下列条件的结构简式____________。
)有多种同分异构体,写出符合下列条件的结构简式____________。
①链状 ②含有醚键 ③核磁共振氢谱显示有三种类型的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )

A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将amol N2与bmol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g), 已知反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol; 反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则:
2NH3(g), 已知反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol; 反应达平衡时,混合气体的体积为716.8 L(标准状况下),其中NH3的体积分数为25%。则:
(1)a的值为______。
(2)平衡时NH3的物质的量为___________。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=___________________。
(4)原混合气体中,a∶b=________。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)=________。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com