

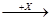 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则甲的化学组成不可能是________(选填序号,下同)。
 ;第三周期第ⅥA族 (2)共价
;第三周期第ⅥA族 (2)共价 4NO2↑+CO2↑+2H2O (4)④
4NO2↑+CO2↑+2H2O (4)④ ;硫元素的原子序数是16,在元素周期表中的位置是第三周期第ⅥA族。
;硫元素的原子序数是16,在元素周期表中的位置是第三周期第ⅥA族。 4NO2↑+CO2↑+2H2O。
4NO2↑+CO2↑+2H2O。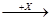 乙
乙 丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则x应该是氧气,所以甲可能是碳、硫或氮气,所以氯气是不可能的,答案选④。
丙,若其中甲是单质,乙、丙为化合物,x是具有氧化性的无色气体单质,则x应该是氧气,所以甲可能是碳、硫或氮气,所以氯气是不可能的,答案选④。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.只有③ | B.①②③④ | C.①②③ | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.b-a=n+m | B.a-b=n-m |
| C.核电荷数Y<X | D.质子数Y>X |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.第ⅠA族 第六周期 | B.第Ⅷ族 第六周期 |
| C.第ⅢB族 第六周期 | D.第ⅢA族 第六周期 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
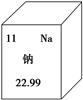
| A.该元素的名称是钠 |
| B.该元素的原子序数为11 |
| C.该元素的地壳中的含量为22.99% |
| D.该元素的元素符号为Na |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
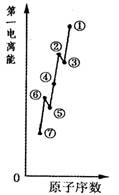
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,草酸钠晶体中存在 (填图中元素代号)。
,草酸钠晶体中存在 (填图中元素代号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②③④ | C.①②④ | D.①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com