
 硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.
硫酸生产主要有硫磺法和硫铁矿法等,这两种制法均经过催化氧化步骤.| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | 4mol SO2、2mol O2、 |
| 平衡时n(SO3) | 1.6mol | n2 | n3 |
| 能量变化 | 放出a kJ | 吸收b kJ | 放出c kJ |
| SO2或SO3的转化率 | α1 | α2 | α3 |
分析 (1)根据反应物和生成物确定反应的历程;
(2)①燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量;
②根据化学平衡常数K计算出平衡时SO3的转化率,继而计算出吸收的热量;
(3)①恒温、恒容条件下,甲、乙为等效平衡,平衡时各物质的含量相同;根据甲容器计算各组分物质的量变化量、平衡时各组分物质的量,可以计算甲、乙中转化率,结合热化学方程式计算b,进而得到甲、乙中转化率之和及热量a、b之和;
②根据甲中的相关数据计算,平衡时生成n(SO3)=1.6mol,可计算各物质的平衡浓度,进而计算平衡常数.
解答 解:(1)V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化,则反应的相关方程式为SO2+V2O5=SO3+2VO2,4VO2+O2=2V2O5,
故答案为:SO2+V2O5═SO3+2VO2,4VO2+O2═2V2O5;
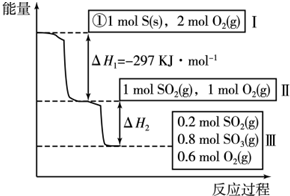
(2)①烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,所以,硫的物质的量为1mol.由图1可知1molS(s)完全燃烧放出的热量为297KJ,所以,硫的燃烧热的热化学方程式S(s)+O2(g)═SO2(g)△H=-297 KJ•mol-1,
故答案为:S(s)+O2(g)=SO2(g)△H=-297 kJ•mol-1;
②根据图象所给的信息可知,反应2SO2(g)+O2(g)?2SO3(g)的平衡常数K=$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})•C({O}_{2})}$=$\frac{0.{8}^{2}}{0.{2}^{2}×0.6}$=$\frac{80}{3}$.
在相同条件下,充入1molSO3和0.5molO2,设反应达到平衡时SO3转化了Xmol,则有:
2SO2(g)+O2(g)?2SO3(g)
初始:0 0.5mol/L 1mol/L
△C:Xmol/L $\frac{X}{2}$ mol/L Xmol/L
平衡:Xmol/L (0.5+$\frac{X}{2}$)mol/L (1-X)mol/L
根据温度不变,平衡常数K的值不变可知:K=$\frac{(1-X)^{2}}{{X}^{2}×(0.5+\frac{X}{2})}$=$\frac{80}{3}$,解得:X=0.2mol,
故反应达到平衡时SO3的转化率为$\frac{0.2mol}{1mol}$×100%=20%.
由热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1可知,2SO3(g)?2SO2(g)+O2(g)△H=-196.6kJ•mol-1即1molSO3分解吸收98.3KJ的热量,则0.2molSO3分解吸收的热量Q=98.3KJ×0.2=19.66KJ.
故答案为:20%;19.66;
(3)①恒温恒容下,甲、乙为完等效平衡,平衡时同种组分的物质的量相等,体积均为1L,最终n(SO3)=1.4 mol,
甲容器:2SO2(g)+O2(g)?2SO3(g)
起始量(mol):2 1 0
变化量(mol):1.6 0.8 1.6
平衡量(mol):0.4 0.2 1.6
则α1=$\frac{1.6mol}{2mol}$=0.8,放出热量为196.6kJ×0.8,
乙容器:α2=$\frac{2mol-1.6mol}{2mol}$=0.2,吸收热量为196.6kJ×0.2,
故α1+α2=0.8+0.2=1,a+b=196.6,
故答案为:1;196.6;
②体积为1L,则由①计算数据可知K=$\frac{1.{6}^{2}}{0.{4}^{2}×0.2}$=80,
故答案为:80.
点评 本题考查化学平衡计算,为高频考点,侧重考查学生的分析、计算能力,本题注意把握等效平衡规律:1、恒温恒容,反应前后气体体积不等,按化学计量数转化到一边,对应物质满足等量;反应前后气体体积相等,按化学计量数转化到一边,对应物质满足等比,2:恒温恒压,按化学计量数转化到一边,对应物质满足等比.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属元素仅存在于矿物中 | |
| B. | 金属元素存在于矿物和动物体內,但植物体內不含 | |
| C. | 少数金属元素以游离态存在,大多数金属元素以化合态存在 | |
| D. | 金属元素仅存在矿物中,动物和植物体內也不存在金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸盐可用于制作光导纤维 | |
| B. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| C. | 明矾溶于水后会产生Al(OH)3胶体,可作为净水剂 | |
| D. | 液氨挥发时会吸收大量的热,可作为制冷剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在. .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如下表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜、二氧化硫都是电解质 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com