
| A、用纯碱做治疗胃酸过多的药品 | B、SiO2是制备光导纤维的主要材料 | C、用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯,以延长保质期 | D、民间用明矾作净水剂除去水中的悬浮物 |


科目:高中化学 来源: 题型:
| A、分子晶体中分子间作用力越大,分子越稳定 | B、原子晶体中共价键越强,则晶体的熔点越高 | C、冰融化时水分子中H-O键未发生断裂 | D、冰的密度比液态水的密度小与水分子间的氢键有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤不正确 | B、③④⑤不正确 | C、除④外其他都不正确 | D、都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在钠、钾、铷,三种单质中,铷的熔点最高 | B、充电电池的化学反应原理是氧化还原反应,充电是使放电时的氧化还原反应逆向进行,燃料电池的能量利用率可达100% | C、化学键可以使离子相结合,也可以使原子相结合 | D、氟利昂-12(CF2Cl2)有两种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 叙述I | 叙述II |
| A | NaHCO3能与碱反应 | NaHCO3用作糕点的膨松剂 |
| B | 实验室常用MgSO4溶液与NaOH溶液制备Mg(OH)2沉淀 | Mg(OH)2不溶于强碱 |
| C | Cl2与Fe反应生成FeCl3 | 把FeCl3溶液直接蒸发结晶可以制备出FeCl3固体 |
| D | 铜丝与浓硫酸反应完,冷却后向试管中加入水来观察CuSO4溶液的蓝色 | 铜与浓硫酸反应生成了CuSO4和SO2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅是高科技的支柱材料,可用于制备太阳能电池板和光导纤维 | B、用浸泡过高锰酸钾溶液的硅藻土吸收水果产生的乙烯可以延长水果的保存期 | C、绿色化学的核心是利用化学原理对环境污染进行治理 | D、明矾常用作净水剂,目的是除去水中的悬浮杂质和有害细菌 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:实验题
(18分)铁是广泛应用的金属。
(1)铁元素在周期表中的位置是 ,工业上通常采用高炉炼铁的方法制得单质铁,请写出用赤铁矿与CO反应炼铁的化学方程式 。
(2)请补充完成实验室制备Fe(OH)3胶体的操作步骤:
①取25ml蒸馏水加热至沸腾
②
③继续煮沸至
④停止加热。
(3)几种离子生成氢氧化物沉淀的pH如下表(已知Fe(OH)2呈絮状,不易从溶液中除去)
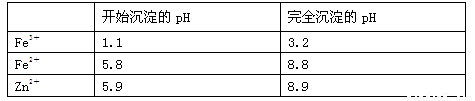
注:开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算现有某溶液含有Fe2+、Fe3+、Zn2+、SO42-,要使溶液中的Fe2+和Fe3+完全沉淀,需往溶液中先加入H2O2,作用是 ,然后再加入NH4HCO3调节pH至 ,NH4HCO3中起调节pH作用的离子是 (填离子符号)
①设计实验探究铁钉和钢钉在碱性溶液中遇到高锰酸钾时是否能发生电化学腐蚀。实验如下
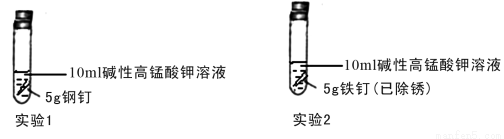
①完成下列表格
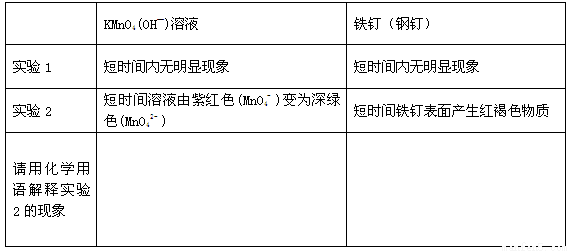
②实验2比实验1能够较快看到以上现象的原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
对于常温下0.1 mol·L-1氨水和0.1 mol·L-1醋酸,下列说法正确的是
A.0.1 mol·L-1氨水,溶液的pH<13
B.0.1 mol·L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1 mol·L-1醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1 mol·L-1醋酸与0.1 mol·L-1NaOH溶液等体积混合所得溶液中:
c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com