
| 选项 | 现象 | 原因或结论 |
| A | 在 H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
| B | 向5mL 0.005mol?L-1FeCl3溶液中加入5mL 0.015mol?L-1KSCN溶液,溶液呈红色,再滴加几滴1mol?L-1KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
| C | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 该反应△H<0,平衡向生成NO2方向移动 |
| D | 在密闭容器中有反应:A+xB(g)?2C(g).达到平衡时测得c(A)为0.5mol/L,将容器容积扩大到原来的两倍,测得c(A)为0.4mol/L-1 | A非气体、x=1 |
| A、A | B、B | C、C | D、D |


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
 实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:
实验室需要0.5mol?L-1硫酸溶液480ml.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| A、a 为电源的负极 | ||||
| B、Fe电极的电极反应是4OH--4e-=2H2O+O2↑ | ||||
| C、通电一段时间后,铁电极附近溶液先变红 | ||||
D、电解饱和食盐水的化学方程式是2NaCl+2H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水加热到很高的温度都难以分解 |
| B、水结成冰体积膨胀,密度变小 |
| C、CH4、SiH4、GeH4、SnH4熔点递增 |
| D、乙醇能与水任意比例互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
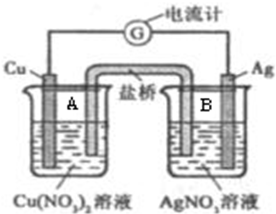 某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:
某原电池构造如图所示.其电池的总反应是:Cu(s)+2Ag+(aq)=Cu2+(aq)+2Ag(s).请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
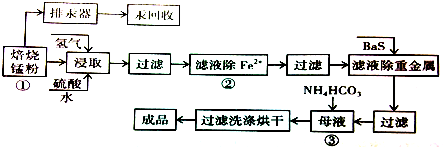

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com