
| 实验步骤 | 现象和结论 |
| 步骤一:取C中的少量固体样品于试管中,滴加足量蒸馏水至完全溶解,然后将溶液分别置于a、b试管中. | |
| 步骤二:向a试管中滴加BaCl2溶液,静置. | 无明显现象,证明固体中不含Na2CO3 |
| 步骤三:取a试管的上层清液于c试管中取a试管的上层清液于c试管中加入适量氢氧化钡溶液 | 产生白色沉淀证明固体中含有碳酸氢钠 |
| 步骤四:向试管b中加入过量稀硝酸溶液向试管b中加入过量稀硝酸溶液再滴加少量硝酸银溶液 | 有白色沉淀生成 则证明固体中含有NaCl |
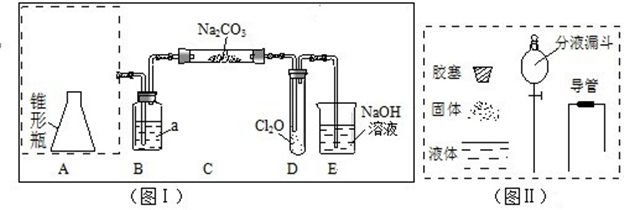
分析 (1)反应是固体和液体不加热制取气体,液体从分液漏斗加入,固体在锥形瓶内加入高锰酸钾固体,导气管露出胶塞,导气管接B装置胶皮管,画出装置图;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,依据氯气与氯化氢水溶性选择除杂剂;
(3)依据氧化还原反应的元素化合价变化,结合电子守恒和原子守恒确定空项物质,配平书写;
(4)依据实验步骤和反应现象,结合物质性质选择试剂,判断反应现象得到结论;
解答 解:(1)把浓盐酸直接滴在KMnO4晶体上就可以产生Cl2.反应是固体和液体不加热制取气体,液体从分液漏斗加入,固体在锥形瓶内加入高锰酸钾固体,导气管露出胶塞,导气管接B装置胶皮管,画出装置图为: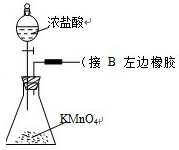 ;
;
故答案为: ;
;
(2)浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以选择饱和食盐水除去氯气中的氯化氢;
故答案为:b;
(3)反应中部分氯元素化合价升高:0→+1价,部分氯元素化合价降低:0→-1价,依据氧化还原反应得失电子守恒,氯化钠系数为2,Cl2O系数为1,依据原子个数守恒,反应方程式:2Cl2+2Na2CO3+H2O=2NaHCO3+2NaCl+Cl2O;
故答案为:2,2,H2O,2,2,1;
(4)对C中反应后的固体成分进行检验,乙实验的方法测定是否含有碳酸钠,碳酸氢钠,氯化钠,依据题干实验步骤,步骤二加入氯化钡检验碳酸钠的存在;步骤三利用酸和碳酸氢钠反应生成碳酸钠,在溶液中和钡离子反应生成白色沉淀证明碳酸氢钠的存在;步骤四加入过量稀硝酸排除其他离子的干扰,加入硝酸银生成白色沉淀判断氯化钠的存在;
故答案为:
| 实验步骤 | 现象和结论 |
| 步骤三:取a试管的上层清液于c试管中加入适量氢氧化钡溶液 | 产生白色沉淀证明固体中含有碳酸氢钠 |
| 步骤四:向试管b中加入过量稀硝酸溶液再滴加少量硝酸银溶液 | 有白色沉淀生成 |
点评 本题考查了实验制取氯气的方法和装置选择,产物判断及验证,熟悉实验原理,明确物质的性质是解题关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇既可以发生催化氧化反应,又可以发生酯化反应 | |
| B. | 用溴水可以鉴别乙醇、乙酸和苯 | |
| C. | 糖类、油脂、蛋白质三类物质都只含有C、H、O三种元素 | |
| D. | C5H10O属于醛类的同分异构体为六种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
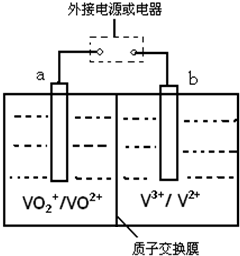
 某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是
某同学将电解池工作时电子、离子流动方向及电极种类等信息表示在如图中,下列有关分析完全正确的是| A | B | C | D | |
| a电极 | 阳极 | 阴极 | 阳极 | 阴极 |
| d电极 | 正极 | 正极 | 负极 | 负极 |
| Q离子 | 阳离子 | 阳离子 | 阴离子 | 阴离子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe | B. | O2 | C. | SO3 | D. | FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 Na2O2可用作漂白剂和呼吸面具中的供氧剂.
Na2O2可用作漂白剂和呼吸面具中的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
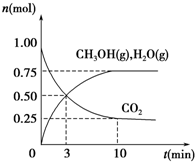 某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )
某温度下,在容积为2L的密闭容器中充入1mol CO2和3.25mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示.下列说法错误的是( )| A. | 该反应的化学方程式为CO2+3H2?CH3OH+H2O | |
| B. | 从反应开始到3 min时,氢气的平均反应速率v(H2)=0.25 mol•L-1•min-1 | |
| C. | 在原容器中再充入1 mol H2能使CO2的转化率增大 | |
| D. | 恒温下,向反应体系中加入固体催化剂,反应产生的热量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
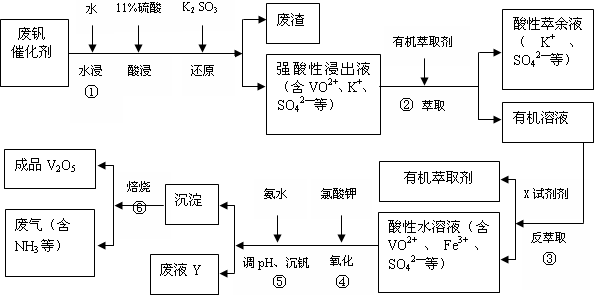
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
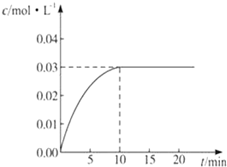 在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:
在某一容积为5L的密闭容器内,加入0.2molCO和0.2molH2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H>0,反应中CO2的浓度随时间变化情况如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com