
分析 (1)根据溶液稀释溶质不变计算需要浓溶液的体积,根据溶液稀释过程操作;
(2)①根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
②根据定容的操作来分析;
③分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)设需要浓溶液体积为x,依据溶液稀释前后溶质不变得:x×30%=100毫升×1g/cm3×10% 解得x=33g,$\frac{33g}{1g/ml}$=33ml,再加入水:67毫升,搅拌均匀;
故答案为:用量筒量取33毫升30%(密度近似为1g/cm3)H2O2溶液加入烧杯中,再加入67毫升水,搅拌均匀;
(2)①操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,用到的仪器有:托盘天平(带砝码)、容量瓶、小烧杯、胶头滴管、玻璃棒、药匙;
故答案为:玻璃棒、药匙;
②定容的操作是先向容量瓶中注水,待液面离刻度线1~2cm时,改用胶头滴管加蒸馏水到溶液的凹液面正好与刻度线相切,
故答案为:改用胶头滴管加蒸馏水到溶液的凹液面正好与刻度线相切;
③a.称量NaOH固体时间过长,氢氧化钠吸收空气中的二氧化碳和水,导致称取的溶质的物质的量偏小,溶液的浓度偏低,故选;
b.容量瓶在用蒸馏水洗净后未干燥,对溶质的物质的量和溶液的体积都不会产生影响,溶液的浓度不变,故不选;
c.在转移溶液时,有少量液体溅出,导致溶质的物质的量偏小,溶液的浓度偏低,故选;
d.定容摇匀后,发现溶液液面低于刻度线,又滴加蒸馏水至刻度线,导致溶液的体积偏大,溶液的浓度偏低,故选;
故选:acd.
点评 本题考查了一定物质的量浓度溶液的配制过程和误差分析,熟悉配制原理和操作过程是解题关键,题目难度不大.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:解答题
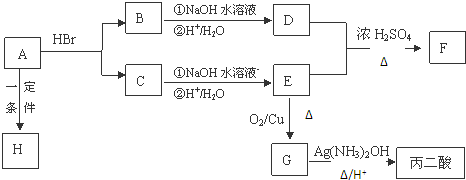
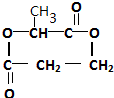 .
.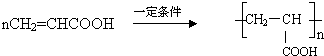 .
.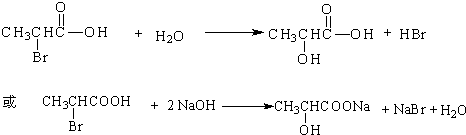 ,其反应类型是取代或水解反应.
,其反应类型是取代或水解反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | Ksp:CaCO3<CaSO4 |
| B | 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成 | 该电极为阳极 |
| C | 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出 | 氧化性:Cu2+>Fe3+ |
| D | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成 | 该溶液中一定含有Ag+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
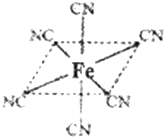 第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti、Ni可与C、H、O形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有8个σ键,1 个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子不存在非极性键 | |
| D. | 丙烯分子中3个碳原子可能在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
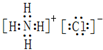 、用电子式表示⑥号物质的形成过程:
、用电子式表示⑥号物质的形成过程: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| Y | ||
| Z |
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是甜的物质,都是糖类 | |
| B. | 单糖是不能发生水解的最简单的糖类 | |
| C. | 淀粉纤维素都是天然有机高分子化合物 | |
| D. | 蔗糖和麦芽糖均为二糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com