
| A.③ | B.④ | C.①③ | D.③④ |
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源:不详 题型:单选题
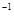 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L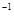
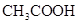 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是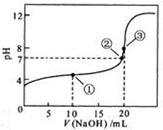
A.点①所示溶液中: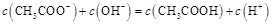 |
B.点②所示溶液中: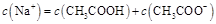 |
C.点③所示溶液中: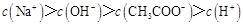 |
D.滴定过程中可能出现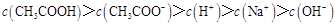 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将pH=5的盐酸稀释100倍后所得的溶液 |
| B.c(H+)=c(OH-)=1×10-6mol·L-1的溶液 |
| C.由强酸、强碱按等物质的量反应得到的溶液 |
| D.非电解质溶于水得到的溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.13 | B.12 | C.11 | D.10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H="–1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(1)△H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H=–269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H= +116.2kJ/mol(反应热) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)> c(HCO3-)> c(CO32-)> c(H+)> c(OH-) |
| B.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| C.c(Na+)= c(HCO3-) + 2c(CO32-) + c(H2CO3 |
| D.c(Na+) + c(H+)= c(HCO3-) + 2c(CO32-) + c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.pH=2的盐酸和pH=12的氢氧化钠溶液 | B.pH=2的盐酸和pH=12的氢氧化钡溶液 |
| C.pH=2的醋酸和pH=12的氢氧化钠溶液 | D.pH=2的盐酸和pH=12的氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com