
下列说法正确的是( )
A.铁是位于第四周期第ⅧB族元素, 是一种重要的过渡元素
B.四氧化三铁是氧化铁和氧化亚铁组成的混合物
C.14克铁粉和7克硫粉混合后高温下充分反应能生成21克硫化亚铁
D.铁在溴蒸气中点燃可生成FeBr3
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大。有关信息如下表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式____________。
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族。下列有关说法正确的是____________(填序号)。
A.原子半径: Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
⑶若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X_____M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 。
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是_________(填“离子化合物”或“共价化合物”),如何通过实验判别__________________。在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为_________。
(5)X、Y组成的一种无色气体遇空气变为红棕色。将标准状况下40 L该无色气体与15 L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐。请写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
小明体检的血液化验单中,葡萄糖为5.9×10-3mol/L。表示该体检指标的物理量是
A.溶解度(s) B.物质的量浓度(c) C.质量分数(w) D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:

 现有下列物质:①Na2CO3•10H2O晶体 ②锌 ③氯化氢 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硫酸 ⑩熔融NaCl ⑾ 蔗糖 (1)按物质的分类方法填写表格的空白处 (填编号) :
现有下列物质:①Na2CO3•10H2O晶体 ②锌 ③氯化氢 ④CO2 ⑤NaHSO4固体 ⑥Ba(OH)2 固体 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硫酸 ⑩熔融NaCl ⑾ 蔗糖 (1)按物质的分类方法填写表格的空白处 (填编号) :
| 分类标准 | 能导电的物质 | 电解质 | 非电解质 |
| 属于该类的物质 |
|
 (2)上述物质中有物质之间在溶液中可发生离子反应:H++OH-══H2O,写出一个该离子反应对应的化学方程式
(2)上述物质中有物质之间在溶液中可发生离子反应:H++OH-══H2O,写出一个该离子反应对应的化学方程式
(3)将⑨滴加到⑦中至过量的实验现象是
(4)将③通入⑧中至恰好完全反应,则溶液导电能力的变化为
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各化学反应的离子方程式中,有错误的是( )
A.铝与氢氧化钠反应:2Al+2OH-+2H2O=2AlO2-+3 H2↑
B.氧化铝溶于氢氧化钠溶液:Al2O3+2OH-=2AlO2-+H2O
C.碘化亚铁溶液中滴入足量溴水:2Fe2++2I-+2Br2=I2+2Fe3++4Br-
D.碳酸氢镁溶液中加过量澄清石灰水
Mg2++2HCO3-+2Ca2++4OH-=2CaCO3↓+2H2O+Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列所作出的结论中一定正确的是( )
A.无色试液使红色石蕊试纸变蓝,结论:该试液一定是碱溶液
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO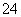
C.无色试液焰色反应呈黄色,结论:试液中一定含有Na+
D.无色试液加入碳酸钠溶液产生白色沉淀,结论:试液中含氢氧化钙
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
完成下列填空,
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1:1,写出Se和浓HNO3的反应方程式 。
如不对该反应还原产物的比例作限制,该反应 出现多组配平系数(填“可能”或“不可能”)并说明理由 。
(2)回收得到的SeO2的含量,可以通过下面的方法测定:
①SeO2+KI十HNO3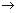 Se+I2+KNO3十H2O
Se+I2+KNO3十H2O
②I2+2Na2S2O3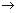 Na2S4O6+2NaI
Na2S4O6+2NaI
实验中,准确称量SeO2样品0.160 0 g,消耗了0.200 0 mol L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
L-1的Na2S2O3溶液25.00mL,所测定的样品中SeO2的质量分数为
Ⅱ.高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、助凝、杀菌、除臭为一体的新型高效多功能绿色水处理剂,具有良好的应用前景。其生产工艺如下:
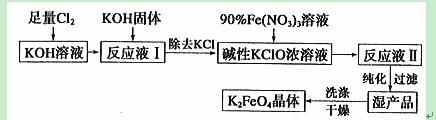
已知:①2KOH+Cl2 KCl+KClO+H2O(条件:温度较低)
KCl+KClO+H2O(条件:温度较低)
②6KOH+3C12 5KCl+KClO3+3H2O(条件:温度较高)
5KCl+KClO3+3H2O(条件:温度较高)
回答下列问题:
(1)该生产工艺应在 (填“温度较高’’或“温度较低”)的情况下进行。
(2)写出Fe(NO3)3在强碱性条件下与KClO反应制K2FeO4的离子方程式 。
(3)在“反应液Ⅰ”中加KOH固体的目的是 (填序号)。
A.与“反应液Ⅰ”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3化为KClO
查看答案和解析>>
科目:高中化学 来源: 题型:
将20 mL 0.3 mol/L AgNO3溶液与10 mL 0.4 mol/L CaCl2溶液混合,所得溶液中离子浓度关系正确的是
A. c(NO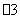 )>c(Ca2+)>c(Cl-) B. c(Ca2+)>c(NO
)>c(Ca2+)>c(Cl-) B. c(Ca2+)>c(NO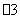 )>c(Cl-)
)>c(Cl-)
C. c(Ca2+)>c(Cl-)>c(NO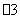 ) D. c(Cl-)>c(Ca2+)>c(NO
) D. c(Cl-)>c(Ca2+)>c(NO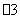 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A、B是中学常见的物质,其阴、阳离子只能从下表中选择:
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH |
| 阴离子 | OH-、NO |
(1)若A、B的水溶 液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
液均为无色,且A的水溶液呈强酸性,B的水溶液呈强碱性。混合后产生不溶于稀盐酸的白色沉淀及能使湿润的红色石蕊试纸变蓝色的气体。
①B的化学式为__________________________________________________________。
②A、B溶液混合加热反应的离子方程式_____________________________________。
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A的化学式为__________________________________________________________。
②经分 析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ________________________________________________________________________;
Ⅱ________________________________________________________________________。
③请用一简易方法证明上述溶液变黄的原因___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com