
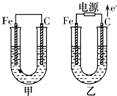
 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:

科目:高中化学 来源: 题型:
| A、K+、Cu2+、Na+、Cl- |
| B、SO42-、Na+、NO3-、CO32- |
| C、Na+、H+、NO3-、SO42- |
| D、Al3+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2(g)+3H2(g)?2NH3(g)△H<0 |
| B、2NO(g)+2CO(g)?2CO2(g)+N2(g)△H<0 |
| C、2HI(g)?H2(g)+I2(g)△H>0 |
| D、2NO2(g)?2NO(g)+O2(g)△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 |
| B、淀粉和纤维素都可以作为工业上生产葡萄糖的原料 |
| C、油脂的水解反应,都是皂化反应 |
| D、蔗糖是高分子化合物,其水解产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
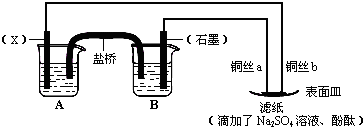
 金属腐蚀的电化学原理可用如图模拟.
金属腐蚀的电化学原理可用如图模拟.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol?L-1Mg(NO3)2溶液中含有0.2nA个NO3- |
| B、8g CH4中含有10nA个电子 |
| C、常温常压下,22.4L O3中含有3nA个氧原子 |
| D、28g C2H4中含有2nA个碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com