

 ;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).
;当温度过高时,尾气中有毒气体的含量会升高,原因是CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO(用化学方程式表示).分析 重晶石和煤粉碎后煅烧粉碎反应生成硫化钡、二氧化碳,尾气主要是一氧化碳,反应后的固体浸取后通入二氧化碳预碳化,加入硫氢化钡溶液反应生成碳酸钡沉淀和硫化氢气体,碳酸钡脱硫后过滤干燥得到碳酸钡产品,
(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,氧化产物为二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,当温度过高时,尾气中有毒气体的含量会升高是高温下碳和二氧化碳反应生成有毒气体一氧化碳;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
(3)碳化时Ba(HS)2和二氧化碳气体发生反应生成碳酸钡沉淀和硫化氢气体;
(4)根据化学平衡常数为生成物的浓度幂之积与反应物的浓度幂之积之比列式,代入Ksp计算;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中存在电荷守恒;
(6)钡餐的主要成分是硫酸钡,硫酸钡难电离,在溶液中不能电离出有毒的钡离子,不会使人体中毒;碳酸钡能与稀盐酸反应生成可溶性的氯化钡,氯化钡能电离出有毒钡离子.
解答 解:(1)碳酸钡粉碎后煅烧和碳反应生成硫化钡和二氧化碳,反应的化学方程式为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑,反应中碳元素化合价升高失电子做还原剂被氧化得到氧化产物二氧化碳,二氧化碳中存在两个碳氧双键,属于共价化合物,电子式为: ,高温下碳和二氧化碳反应生成有毒气体一氧化碳:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
,高温下碳和二氧化碳反应生成有毒气体一氧化碳:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
故答案为:BaSO4+2C$\frac{\underline{\;高温\;}}{\;}$BaS+2CO2↑; ;CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
;CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)提高浸取速率可以升温、搅拌、粉碎增大接触面积等措施;
故答案为:适当提高温度(或搅拌等);
(3)碳化时Ba(HS)2和H2S气体粉碎反应生成碳酸钡沉淀和硫化氢气体,反应的离子方程式为:CO2+H2O+Ba2++2HS-=BaCO3↓+H2S↑;
故答案为:CO2+H2O+Ba2++2HS-=BaCO3↓+2H2S↑;
(4)CO32-+BaS2O3═BaCO3+S2O32-,该反应的平衡常数K=$\frac{c({S}_{2}{{O}_{3}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({S}_{2}{{O}_{3}}^{2-})•c(B{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(B{a}^{2+})}$$\frac{Ksp(Ba{S}_{2}{O}_{3})}{Ksp(BaC{O}_{3})}$=$\frac{1.6×1{0}^{-5}}{2.5×1{0}^{-9}}$=6.4×103;
故答案为:6.4×103;
(5)Ba(HS)2溶液中溶质是强碱弱酸盐,HS-离子水解程度大于其电离程度溶液显碱性,溶液中离子浓度大小为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-),溶液中存在电荷守恒2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);
故答案为:c(HS-)>c(Ba2+)>c(OH-)>c(H+)>c(S2-);2c(Ba2+)+c(H+)=c(HS-)+2c(S2-)+c(OH-);
(6)碳酸钡与稀盐酸反应生成氯化钡、水和二氧化碳,该反应的化学方程式为:BaCO3+2HCl=BaCl2+CO2↑+H2O,BaCO3与胃酸中的盐酸反应生成可溶性的重金属盐氯化钡会使人中毒;
故答案为:BaCO3 与胃酸中的盐酸反应生成可溶性的重金属盐BaCl2,会使人中毒.
点评 本题考查了物质制备工艺流程分析,主要是程度溶解平衡常数计算、电解质溶液中离子浓度大小比较、电荷守恒等知识点,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
 本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:
本月4日,谷歌公司宣布:以60胜O负1平的战绩横扫众多围棋高手的神秘棋手“Master”乃是其人工智能产品AlpbaGo的升级版,人工智能再次成为热门话题.其中,高纯度硅是一种重要的基础材料.以下是工业上制取纯硅的一种方法:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S2-、K+、NO3-、SO42- | B. | H+、Na+、HCO3-、SO42- | ||
| C. | NH4+、Al3+、NO3-、Cl- | D. | Na+、K+、S2O32-、F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中的能量变化除了热能外,还可以是光能、电能等 | |
| B. | 放热反应的△H<0 | |
| C. | 需要加热才能发生反应一定是吸热反应 | |
| D. | 反应物的总能量低于生成物的总能量时,发生吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装盐酸的滴定管用蒸馏水洗干净后立即装入盐酸 | |
| B. | 滴加盐酸时滴到锥形瓶外 | |
| C. | 滴定达到终点时,振荡时待测液溅出锥形瓶 | |
| D. | 滴定前装盐酸的滴定管有气泡,滴定后气泡消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该温度下平衡常数K=1 | |
| B. | 平衡时通入CO气体,则再次达平衡时,H2O的转化率增大.而CO的转化率减小 | |
| C. | 平衡时CO的体积分数为25% | |
| D. | 平衡常数与反应温度无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
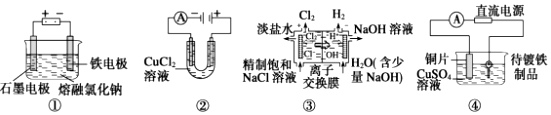
| A. | 装置①工业上可用于生产金属钠,电解过程中石墨电极产生金属 | |
| B. | 装置②中阳极产生的气体可以使湿润的淀粉碘化钾试纸变蓝 | |
| C. | 装置③中的离子交换膜允许阳离子、阴离子和小分子水通过 | |
| D. | 装置④的待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验I:实验室制备氨气 | |
| B. | 实验Ⅱ:用二氧化碳作喷泉实验 | |
| C. | 实验Ⅲ:进行中和热的测定 | |
| D. | 实验Ⅳ:电解氯化铜溶液得到铜和氯气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com