
| A. | 反应过程中不可能产生H2 | |
| B. | 剩余的金属粉末中一定有铜 | |
| C. | 往反应后的溶液中加入KSCN 溶液会变血红色 | |
| D. | 往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
分析 铁比铜活泼,将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,首先是较活泼的铁与酸溶液反应,当铁完全反应后,且溶液中存在:H+、(Fe3+)、NO3-时,铜溶解,所以剩余金属可能为铁或铁与铜的混合物,由于发生:Fe+2Fe3+=3Fe2+,Cu+2Fe3+=2Fe2++Cu2+,则当金属粉末有剩余,溶液中不存在Fe3+,当溶液中NO3-完全消耗时,加入硫酸,金属不再溶解,据此进行判断.
解答 解:A.铁比铜活泼,硝酸氧化性大于硫酸,将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,首先是较活泼的铁与在酸性条件下与NO3-反应,当溶液中NO3-完全消耗时,铁和H+反应生成H2,故A错误;
B.铁比铜活泼,将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,首先是较活泼的铁与酸溶液反应,当铁完全反应后,且溶液中存在:H+、(Fe3+)、NO3-时,铜溶解,所以剩余金属可能为 铜或铁与铜的混合物,所以剩余金属一定含有铜,故B正确;
C.由于发生:Fe+2Fe3+=3Fe2+,Cu+2Fe3+=2Fe2++Cu2+,则当金属粉末有剩余,溶液中不存在Fe3+,加入KSCN溶液不一定变成血红色,故C错误;
D.当剩余金属为铜时,且溶液中NO3-完全消耗时,加入硫酸,金属不再溶解,故D错误;
故选B.
点评 本题考查金属的活泼性比较以及硝酸的化学性质,题目难度中等,明确发生反应的先后顺序为解答关键,易错点为A、D,注意把握金属的活泼性强弱以及NO3-的性质,试题侧重考查学生的分析、理解能力.


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:选择题
| A. | 将蒸馏水缓慢注入盛有一定量浓硫酸的烧杯中,并不断搅拌至冷却 | |
| B. | 必须的定量仪器有100mL量筒、250mL容量瓶和托盘天平 | |
| C. | 量取质量分数为98%的浓硫酸(ρ=1.84g•cm-3)的体积为25.0mL | |
| D. | 先在容量瓶中加入适量水,将量好的浓硫酸注入容器瓶加入定容 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 硫元素既被氧化又被还原 | |
| B. | 氧化剂与还原剂的物质的量之比为1:2 | |
| C. | 每生成1molNa2S2O3,转移4mol电子 | |
| D. | 相同条件下,每吸收10m3SO2就会放出2.5m3CO2 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
标准状况下某种O2和N2的混合气体x g含有a个分子,则y g该混合气体在相同状况下所占的体积应是( )
A. L B.
L B. L C.
L C. L D.
L D. L
L
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度越高,催化剂的催化效果越好 | |
| B. | 汽车排气管上的“催化转化器”能减少有害气体排放 | |
| C. | 催化剂可以改变化学反应速率,但不能破坏化学平衡 | |
| D. | 催化剂可以改变化学反应路径,且反应前后其质量和化学性质都不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.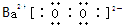 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
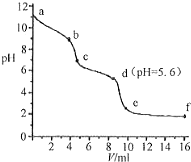 常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )
常温下,将已知浓度的盐酸滴定到未知浓度的Na2CO3溶液,用pH传感器测得混合溶液的pH变化曲线,如图所示:(已知饱和CO2溶液的pH为5.6)下列说法正确的是( )| A. | a点时,溶液呈碱性的原因是CO32-发生水解反应,其离子方程式为:CO32-+2H2O=H2CO3+2OH- | |
| B. | a→b段,溶液有气体放出 | |
| C. | c点以后,盐酸过量 | |
| D. | d点溶液中c(Na+)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )
已知电解熔融氧化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按图中箭头所表示的物质间可能发生的转化,分析下列说法正确的是( )| A. | CaO、Ca(OH)2、CaCO3三者都是离子化合物,在固态时可以导电 | |
| B. | 工业上也可用电解熔融氧化钙的方法制备金属钙 | |
| C. | 往Ca(OH)2溶液中滴加Na2CO3溶液或NaHCO3溶液,都能实现⑥的转化 | |
| D. | 工业上以氯气和石灰乳为原料通过反应制造主要成分为CaCl2的漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+3O2(g)=4CO (g)+2H2O(l)△H=+1468 kJ•mol-1 | |
| B. | 在③反应时,若加入催化剂,可以使△H减小 | |
| C. | 若有3.2g CH4与足量水蒸汽按③反应,则放出热量是43.2 kJ | |
| D. | 若生成相同质量的CO2,则放出的热量C2H2大于CO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com