
| A. | 用激光笔照射淀粉溶液和葡萄糖溶液,能产生光亮的“通路”的是淀粉溶液 | |
| B. | 将某气体通入淀粉碘化钾溶液中,溶液变蓝色,该气体一定是Cl2 | |
| C. | 向某溶液中加入AgNO3溶液,产生白色沉淀,该溶液中一定含Cl- | |
| D. | 向某稀溶液中加入少量NaOH溶液,未产生使湿润的红色石蕊试纸变蓝的气体,该溶液中一定 不含NH4+ |
科目:高中化学 来源: 题型:解答题
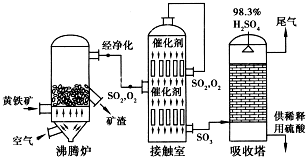
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molO3与11.2LO2所含的分子数一定相等 | |
| B. | 25℃与60℃时,水的pH相等 | |
| C. | 中和等体积、等物质的量的浓度的盐酸和醋酸所消耗的n(NaOH)相等 | |
| D. | 2SO2(g)+O2(g)=2SO3(g)和4SO2(g)+2O2(g)=4SO3(g)的△H相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10NA | |
| C. | 在含4mol Si-O键的二氧化硅中,氧原子数为4NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
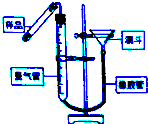 过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.
过氧化钙(CaO2•8H2O)是一种在水产养殖中广泛使用的供氧剂.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
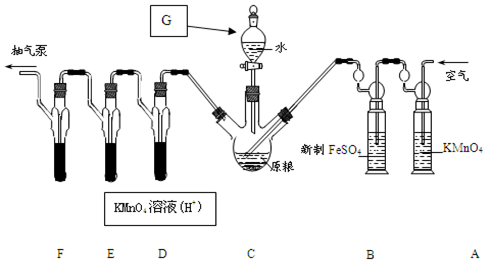
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
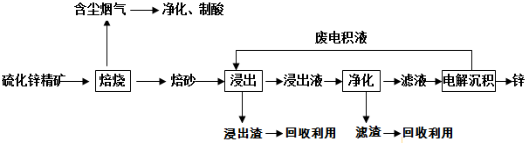
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com