
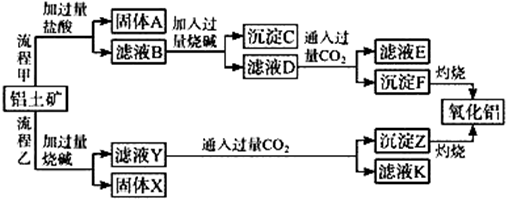
分析 由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,以此来解答.
解答 解:由工艺流程甲可知,铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质),铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3;
根据工艺流程乙可知,铝土矿中的Al2O3、SiO2能和氢氧化钠反应,可知固体X为Fe2O3、MgO等,滤液Y为硅酸钠、偏铝酸钠,滤液中通入过量二氧化碳,沉淀Z为Al(OH)3、硅酸,滤液K中含有NaHCO3,
(1)Al2O3与盐酸反应生成氯化铝和水,氧化物不能拆,离子方程式为:Al2O3+6H+═2Al3++3H2O,故答案为:Al2O3+6H+═2Al3++3H2O;
(2)二氧化硅与氢氧化钠反应生成硅酸钠和水,二氧化硅不能拆,故离子反应方程式为:SiO2+2OH-═SiO32-+H2O,故答案为:SiO2+2OH-═SiO32-+H2O;
(3)Fe3+与硫氰化钾溶液反应,使溶液变红色,检验滤液B中是否含Fe3+离子的方法为:取少量滤液B,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+,溶液不变红色,说明滤液中不含Fe3+,
故答案为:硫氰化钾;
(4)根据工艺流程甲可知,固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠,所以向滤液D中通入过量二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,则滤液E中溶质为NaHCO3,碳酸氢钠可用于制纯碱或做发酵粉等,
故答案为:NaHCO3.
点评 本题以氧化铝提取工艺流程为载体考查混合物分离实验方案的设计,为高频考点,涉及无机物推断、元素化合物性质及相互转化、除杂的方法、离子方程式等,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 橙花醇的分子式为C15H24O | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 在一定条件下能发生取代、催化氧化、酯化、加聚反应 | |
| D. | 0.1mo1橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗0.3mo1Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
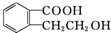 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: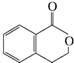 、C.
、C.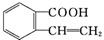 、D.
、D.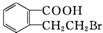 .
. .
.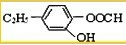 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为7、中子数为8的氮原子:87N | |
| B. | 溴化铵的电子式: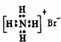 | |
| C. | 乙酸的比例模型: | |
| D. | 间硝基甲苯的结构简式: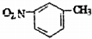 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠溶液呈碱性,可用热的纯碱溶液除去油脂 | |
| B. | 硝酸与铁发生化学反应,不可用铁制容器盛装浓硝酸 | |
| C. | 铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品 | |
| D. | H2与Cl2光照发生爆炸,工业上不能用H2与Cl2做原料生产HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.2 mol/L的NH4Al(SO4)2溶液与0.3 mol/L的Ba(OH)2溶液等体积混合:2NH4++Al3++3SO42-+3Ba2++6OH-═Al(OH)3↓+AlO2-+3BaSO4↓+2H2O | |
| B. | 将含有等物质的量溶质的NaHCO3溶液和Ba(OH)2溶液混合:Ba2++HCO${\;}_{3}^{-}$+OH-═BaCO3↓+H2O | |
| C. | 在重铬酸钾溶液中,加酸后溶液变为黄色:Cr2O72-+H2O═2 CrO42-+2H+ | |
| D. | 过量氯水与FeI2溶液作用:2Fe2++2I-+2Cl2═2 Fe3++I2+4Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com