
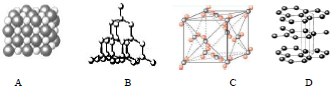
分析 根据不同物质晶体的结构特点来辨别图形所代表的物质.NaCl晶胞是简单的立方单元,干冰也是立方体结构,但在立方体每个正方形面的中央都有一个CO2分子,称为“面心立方”,金刚石的基本单元是正四面体,为空间网状结构,石墨是分层结构.
(1)金刚石是空间网状结构,每个碳原子连接4个碳原子,原子间以共价键相结合;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,在层内碳与碳以共价键相互作用,形成六边形;
(3)金刚石与石墨是由碳元素组成的物理性质不同的单质,互为同素异形体;
(4)CO2分子位于立方体的顶点和面心上,干冰是分子晶体;
(5)干冰是分子晶体,分子间存在分子间作用力,其构成微粒是分子;
(6)熔点的一般规律:原子晶体>离子晶体>分子晶体.
解答 解:(1)金刚石是空间网状结构,每个碳原子连接4个碳原子,原子间以共价键相结合,属于原子晶体,B符合;
故答案为:B;
(2)石墨是层状结构,在层与层之间以范德华力相互作用,有分子晶体的特点,在层内碳与碳以共价键相互作用,形成六边形,E符合;
故答案为:E;
(3)金刚石和石墨互称碳的同素异形体;
故答案为:同素异形体;
(4)CO2分子位于立方体的顶点和面心上,代表干冰的是C,它属于分子晶体;
故答案为:分子;
(5)CO2分子间通过分子间作用力结合起来;
故答案为:分子间作用力;
(6)熔点的一般规律:原子晶体>离子晶体>分子晶体,上述物质中A、B、C分别为NaCl晶体、石墨、干冰,则熔点:B>A>C;
故答案为:B>A>C.
点评 本题考查了常见晶体的晶胞图、不同晶体的熔点比较,题目难度不大,注意把握不同晶体中微粒之间的作用力以及晶体熔沸点的比较方法.


科目:高中化学 来源: 题型:选择题
| A. | 其最高正价为+3价 | B. | 其最低负价可能为-1价 | ||
| C. | 氢化物溶于水,水溶液一定显酸性 | D. | 其最高价氧化物对应水化物为强碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
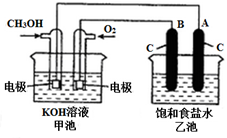 甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O
甲醇是一种可再生能源,具有广泛的开发和应用前景.如图是用甲醇燃料电池电解饱和食盐水的装置示意图.已知甲池的总反应式为:2CH3OH+3O2+4KOH═2K2CO3+6H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题
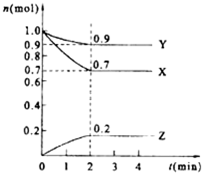 某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示. 2Z;
2Z;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
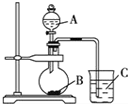 某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.
某研究性学习小组设计了一组实验验证非金属元素的非金属性越强,对应的最高价含氧酸的酸性就越强.他们设计了如图装置以验证 氮、碳、硅元素的非金属性强弱.他们设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验操作 | 实验目的 | |
| A | 制乙炔时用饱和食盐水代替水 | 加快化学反应速率 |
| B | CH4与SO2混合气体通过盛有溴水的洗气瓶 | 除去中CH4的SO2 |
| C | 甲烷与乙烯的混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去甲烷中的乙烯 |
| D | 将浓硫酸、乙醇混合加入试管中,加热,然后将导管末端插入酸性KMnO4溶液中,观察现象; | 检验是否有乙烯生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
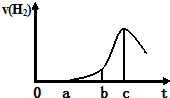 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
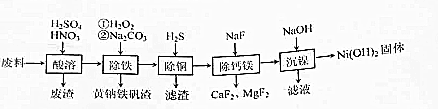
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com