
【题目】(1)根据原子结构、元素周期表和元素周期律的知识回答下列问题:
①X是1~36号元素原子核外电子排布中未成对电子数最多的元素,X元素的名称是___,在元素周期表中的位置是___,位于周期表___区。。
②C、N、O、F四种元素第一电离能由大到小的顺序为___。
(2)早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
①基态铜原子的电子排布式为___。
②CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是___;Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___个铜原子。
【答案】铬 第四周期第ⅥB族 d区 FNOC [Ar]3d104s1 Cu2O中Cu+电子排布为[Ar]3d10,3d轨道全充满,较稳定;而CuO中Cu2+中3d轨道排布为3d9,不稳定 16
【解析】
要寻找1~36号元素原子核外电子排布中未成对电子数最多,只要找到3d轨道和4s轨道呈半满状态的元素即可;同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,但氮的价电子式为2s22p3呈半充满状态,第一电离能大于相邻元素;铜为29号元素。
(1)①根据核外电子的排布式可知,3d轨道和4s轨道呈半满状态的元素为铬,则铬是1~36号元素原子核外电子排布中未成对电子数最多的元素;铬元素位于第四周期第ⅥB族,处于元素周期表的d区。
②同一周期中,元素的第一电离能随着原子相等的增大而呈增大趋势,但氮的价电子式为2s22p3呈半满状态,第一电离能大于相邻元素,所以四种元素的第一电离能大小顺序是F>N>O>C。
(2)①铜为29号元素,核外电子数为29,因全充满或半充满状态是稳定的,故基态铜原子的电子排布式为[Ar]3d104s1。
②Cu2O中铜元素显+1价,Cu+电子排布为[Ar]3d10,3d轨道全充满,较稳定,CuO中铜元素显+2价,Cu2+电子排布为[Ar]3d9,不稳定,故Cu2O比CuO更稳定;Cu2O的立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则晶胞中氧原子的个数为![]() ,铜原子与氧原子的个数比为2:1,则该晶胞中有16个铜原子。
,铜原子与氧原子的个数比为2:1,则该晶胞中有16个铜原子。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】化合物M属于功能高分子材料。实验室由化合物A和B制备M(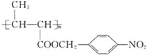 )的一种合成路线如下:
)的一种合成路线如下:

已知: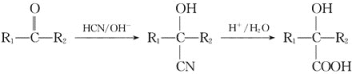 (R1、R2表示氢原子或烃基)。
(R1、R2表示氢原子或烃基)。
回答下列问题:
(1)A的结构简式为______;B中官能团的名称为_____;C的化学名称为_____。
(2)由B生成F和由D生成E的反应类型分别为____、____;由G生成H的反应试剂和反应条件分别为______。
(3)由E和I生成M的化学方程式为_________________________________。
(4)同时满足下列条件的E的同分异构体共有________种(不考虑立体异构,不包括本身)。
①硝基与苯环直接相连。 ②与钠反应放出H2。
(5)参照上述合成路线和信息,设计以丙酮为原料无机试剂任选,制备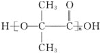 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 与
与![]()
![]() 的盐酸反应(放热反应)生成
的盐酸反应(放热反应)生成![]() 的量与反应时间的关系如图所示,下列结论不正确的是( )
的量与反应时间的关系如图所示,下列结论不正确的是( )
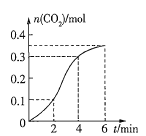
A.反应开始2min内平均反应速率最大
B.反应速率先增大后减小
C.2~4min内温度对反应速率的影响较大
D.反应在2~4min内生成![]() 的平均反应速率为
的平均反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
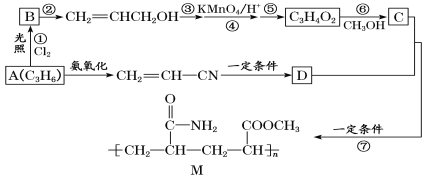
【题目】烯烃在化工生产过程中有重要意义。如图所示是以烯烃A为原料合成粘合剂M的路线图。
回答下列问题:
(1)下列关于路线图中的有机物或转化关系的说法正确的是__(填字母)。
a.A能发生加成反应、氧化反应、缩聚反应
b.B的结构简式为CH2ClCHClCH3
c.C的分子式为C4H5O3
d.M的单体是CH2=CHCOOCH3和![]()
(2)A分子中所含官能团的结构简式是__反应①的反应类型为__。
(3)设计反应③⑤的目的是__,C的名称为__。
(4)C和D生成M的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为__,该物质的分子式是__。
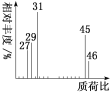
(3)根据价键理论,预测A的可能结构并写出结构简式:__。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如,甲基氯甲基醚(ClCH2OCH3,有2种氢原子)的核磁共振氢谱如图甲所示:
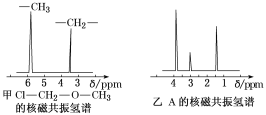
经测定,有机物A的核磁共振氢谱如图乙所示,则A的结构简式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是( )
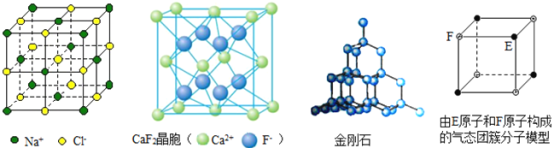
A. 在NaCl晶体中,距Na+最近的Cl-有6个
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某元素原子共有3个价电子,其中一个价电子位于第三能层![]() 能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
能级,该能层有______个原子轨道,该元素基态原子的价电子排布图为______。
(2)![]() 、
、![]() 均为短周期金属元素。依据下表数据,写出
均为短周期金属元素。依据下表数据,写出![]() 原子的核外电子排布式:______。
原子的核外电子排布式:______。
电离能/ |
|
|
|
|
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是425℃时,在1 L密闭容器中发生化学反应的浓度随时间的变化示意图。
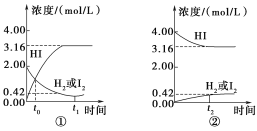
下列叙述错误的是( )
A. 图①中t0时,三种物质的物质的量相同
B. 图①中t0时,反应达到平衡状态
C. 图②中的可逆反应为2HI(g) ![]() H2(g)+I2(g)
H2(g)+I2(g)
D. 图①②中当c(HI)=3.16 mol/L时,反应达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com