
在含NaCl、KCl、![]() 四种物质的溶液中,已知
四种物质的溶液中,已知![]() 的物质的量浓度分别为0.80mol/L、0.70mol/L和0.40mol/L,则
的物质的量浓度分别为0.80mol/L、0.70mol/L和0.40mol/L,则![]() 的物质的量浓度为
的物质的量浓度为
[ ]
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.
(2012?丰台区一模)(1)A为用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)的装置.| 假设 | 主要操作 | 现象 | 结论 |
| 假设1: | |||
| 假设2:可能是H+与OH-中和,导致溶液褪色 |

查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)海洋是一个远未完全开发的巨大化学资源宝库,海洋资源的综合利用具有非常广阔的前景。工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。
试回答下列问题:
(1)蒸馏法是人类最早使用的淡化海水的方法。
你认为蒸馏法海水淡化最理想的能源是 ▲ 。
(2)从海水中可得到多种化工原料和产品。下列是海水资源利用的流程图。
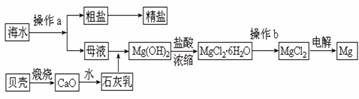
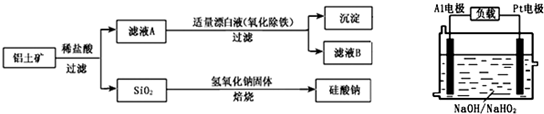
①流程图中操作a的名称为 ▲ 。
②工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。气体A、B是CO2或NH3,则气体B应是 ▲ 。(填化学式)
③镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
a.若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是: ▲ 。
b.操作b是在 ▲ 气氛中进行,若在空气中加热,则会生成Mg(OH)Cl,写出有关反应的化学方程式 ▲ 。
c.在母液苦卤中含有较多的NaCl、MgCl2、KCl、MgSO4等物质。用沉淀法测定苦卤中Mg元素的含量(g/L),实验过程中应测定的数据有 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com