
用所学知识回答问题:
(1)浓硝酸久置常会显黄色,是因为 (用化学反应方程式表示),可采用 的方法消除黄色.
(2)酸性高锰酸钾溶液的氧化性比普通高锰酸钾的氧化性强,酸化时所用的酸为 ,向酸性KMnO4溶液中加入KI溶液,溶液紫红色褪去(所得溶液可使淀粉溶液变蓝),请写出KMnO4溶液褪色的离子方程式
(3)硫化氢的水溶液久置于空气中会变浑浊,请写出相关的化学反应方程式
(4)配平下面的化学方程式: Cu2O+ HNO3→ Cu(NO3)2+ NO↑+ H2O.
考点: 氧化还原反应;氧化还原反应方程式的配平;硝酸的化学性质.
分析: (1)浓硝酸见光易分解,以此来解答;
(2)根据酸性高锰酸钾溶液的氧化性比氯气氧化性强,所以不能用盐酸来酸化;KMnO4溶液氧化KI溶液生成二价锰离子和碘单质,根据得失电子守恒书写;
(3)硫化氢的水溶液久置于空气中会变氧气氧化生成硫单质;
(4)Cu2O→2Cu2+,铜元素由+1价→+2价,化合价升高2价;HNO3→NO,氮元素由+5价→+2价,化合价降低3价,所以其最小公倍数为6,故Cu2O的系数为3,硝酸除表现氧化性之外还生成硝酸铜,表现酸性,据Cu原子守恒,硝酸铜前的化学计量数为6,据氮原子守恒和电子守恒,硝酸的化学计量数为14,然后利用质量守恒定律配平.
解答: 解:(1)浓硝酸见光易分解,硝酸分解产生的NO2溶解于硝酸时其为黄色,方程式为:4HNO3(浓)=2H2O+4NO2↑+O2↑,可采用通入空气的方法与二氧化氮和水反应再生成硝酸,从而消除黄色,故答案为:4HNO3(浓)=2H2O+4NO2↑+O2↑;通入空气;
(2)因为酸性高锰酸钾溶液的氧化性比氯气氧化性强,所以酸性高锰酸钾溶液能氧化盐酸生成氯气,则不能用盐酸来酸化,应用硫酸酸化;KMnO4溶液氧化KI溶液生成二价锰离子和碘单质,离子方程式为2MnO4﹣+10I﹣+16H+=2Mn2++5I2+8H2O,故答案为:硫酸,2MnO4﹣+10I﹣+16H+=2Mn2++5I2+8H2O;
(3)硫化氢的水溶液久置于空气中会变氧气氧化生成硫单质,反应方程式为:2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O;
(4)Cu2O→2Cu2+,铜元素由+1价→+2价,化合价升高2价;HNO3→NO,氮元素由+5价→+2价,化合价降低3价,所以其最小公倍数为6,故Cu2O的系数为3,硝酸除表现氧化性之外还生成硝酸铜,表现酸性,据Cu原子守恒,硝酸铜前的化学计量数为6,据氮原子守恒和电子守恒,硝酸的化学计量数为14,然后利用质量守恒定律配平,方程式为3Cu2O+14HNO3→6Cu(NO3)2+2NO↑+7H2O,故答案为:3;14;6;2;7.
点评: 本题考查氧化还原反应,根据元素化合价变化来分析解答即可,明确元素化合价的解本题的关键,难度不大,注重基础知识的考查.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
|
| A. | HCl和NaOH反应的中和热△H=﹣57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(﹣57.3)kJ/mol |
|
| B. | CO(g)的燃烧热是283.0 kJ/mol,则2C02(g)=2CO(g)+02(g)反应的△H=+2×283.0 KJ/mol |
|
| C. | 反应A(s)+B(g)=C(s)+D(s)能自发进行,则一定有△H>0 |
|
| D. | 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为探究元素周期表中元素性质的递变规律,设计了如下实验.
Ⅰ.将钠、钾、镁、铝各1mol分别投入到足量的同浓度的盐酸中,试预测实验结果: 与盐酸反应最剧烈, 与盐酸反应的速度最慢.
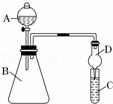
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律
(1)检验该装置气密性的操作方法是 ,干燥管D的作用是 .
(2)现有试剂:盐酸、碳酸钙、澄清石灰水、硅酸钠溶液,请从中选择试剂并用如图装置证明酸性:HCl>H2CO3>H2SiO3.则B中应盛装的试剂为 ,C中产生的现象为 有 .请判断 (填“能”或“不能”)根据实验现象判断非金属性:Cl>C>Si.
(3)若C中盛装的是Na2S溶液,A中盛装浓盐酸,B中盛装KMnO4粉末.(KMnO4与浓盐酸常温下快速反应生成氯气)反应开始后观察到C中出现淡黄色浑浊,可证明Cl的非金属性比S (填“强”或者“弱”或者“无法比较”),写出反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
汞(熔点﹣39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞.目前工业上制粗汞的一种流程图如下.

下列分析错误的是( )
A. “灼烧辰砂法”过程中电子转移的方向和数目可表示为: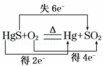
B. 辰砂与氧化钙加热反应时,CaSO4为氧化产物
C. 洗涤粗汞可用5%的盐酸代替5%的硝酸
D. 减压蒸馏的目的是降低汞的沸点,提高分离效率
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应对应的离子方程式书写正确的是( )
A. 漂白粉溶液在空气中生效:Ca2++2ClO﹣+CO2+H2O=2HClO+CaCO3↓
B. 用KIO3氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O=3I2+6OH﹣
C. 氯化铁溶液与铜反应:Fe3++Cu=Fe2++Cu2+
D. 0.01 mol•L﹣1NH4Al(SO4)2溶液与0.02 mol•L﹣1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+Al(OH)3↓+NH3•H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关银镜反应实验的说法正确的是( )
A.实验前试管先用热的烧碱溶液洗涤,再用蒸馏水洗涤
B.向2%的稀氨水中滴入2%的硝酸银溶液,配得银氨溶液
C.可采用水浴加热,也可直接加热
D.可用浓盐酸洗去银镜
查看答案和解析>>
科目:高中化学 来源: 题型:
在搪瓷和陶瓷器皿具表面的釉质中含有极微量的Pb、Cd、Sb等有毒金属盐类为防止中毒,不能长期盛放下列物质的是( )
A.食盐 B.酱油 C.蔗糖 D.食醋
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( )
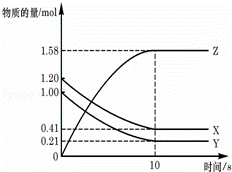
A.反应开始到10s,用Z表示的反应速率为0.158mol/(L•s)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y转化了0.79mol
D.反应的化学方程式为:X(g)+Y(g)⇌Z(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com