
| A. | AlCl3与过量NaOH溶液反应生成AlO${\;}_{2}^{-}$,则与过量NH3•H2O也生成AlO${\;}_{2}^{-}$ | |
| B. | Na2O2与CO2反应生成Na2CO3和O2,则与SO2反应可生成Na2SO3和O2 | |
| C. | Fe与Cl2反应生成FeCl3,则与I2反应可生成FeI3 | |
| D. | Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应 |
分析 A.氢氧化铝是两性氢氧化物,溶于强酸、强碱,不溶于弱酸和弱碱;
B.过氧化钠具有氧化性能氧化二氧化硫得到硫酸钠;
C.碘单质氧化性弱和铁反应生成低价的化合物;
D.铝热反应中制取的金属的还原性应该小于铝的还原性;
解答 解:A.AlCl3与过量NaOH溶液反应生成氢氧化铝沉淀会溶解于氢氧化钠溶液中,但氢氧化铝不溶于氨水,故A错误;
B.Na2O2具有强氧化性,能将SO2氧化成Na2SO4,故B错误;
C.I2氧化性较弱,与Fe反应可生成FeI2,故C错误;
D.铝在高温条件下具有强还原性,可以冶炼难熔金属,Al与Fe2O3能发生铝热反应,则与MnO2也能发生铝热反应,故D正确;
故选D.
点评 本题考查了金属及其化合物性质的理解应用,主要是反应产物和反应实质的熟练掌握,题目难度中等.


科目:高中化学 来源: 题型:解答题
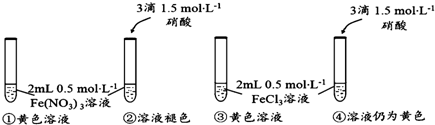

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ag+、NO3-、Cl-、K+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液晶态介于晶体状态和液态之间,液晶具有一定程度的晶体的有序性和液体的流动性 | |
| B. | 常压下,0℃时冰的密度比水的密度小,水在4℃时密度最大,这些都与分子间的氢键有关 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 单质硅是将太阳能转变为电能的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
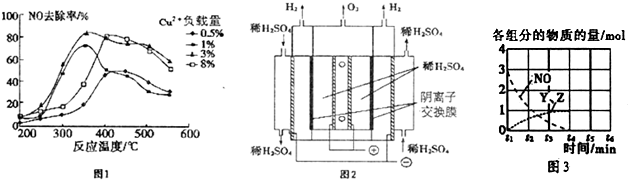
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素的化学式相同,两者互为同分异构体 | |
| B. | 苯能和氢气发生加成反应,是由于其结构中有碳碳双键 | |
| C. | 紫外线杀菌是在紫外线条件下,蛋白质发生盐析杀死细菌 | |
| D. | 乙醇和乙酸都能与金属钠反应放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
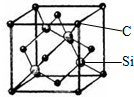 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1KAl(SO4)2溶液中含0.2NA个SO42- | |
| B. | 常温下,9gH2O含NA个O-H键 | |
| C. | 同温同压同体积的CO2、SO2所含氧原子数均为2NA | |
| D. | 32gCu与S完全反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
一定条件下,在某密闭容器中进行如下反应:mA(g)+nB(g) pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是
pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,反应速率随时间的变化过程如图所示,则对该反应的叙述正确的是

A.正反应是吸热反应
B.逆反应是放热反应
C.m+n>p+q
D.m+n<p+q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com