
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液中水的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a4。下列关系式中正确的是
A.a2 = a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
【答案】A
【解析】
试题分析:在25 ℃时,纯水中![]() mol·L-1,纯水的电离度为α1;pH=2的醋酸溶液中c(H+)=10-2mol·L-1,水电离出来的氢离子的浓度与氢氧根的浓度相等,即
mol·L-1,纯水的电离度为α1;pH=2的醋酸溶液中c(H+)=10-2mol·L-1,水电离出来的氢离子的浓度与氢氧根的浓度相等,即![]() ,水的电离度为α2,醋酸电离出来的氢离子要抑制水的电离,α2<α1;同理可得pH=12的氢氧化钠溶液中c(OH-)=10-2 mol·L-1,
,水的电离度为α2,醋酸电离出来的氢离子要抑制水的电离,α2<α1;同理可得pH=12的氢氧化钠溶液中c(OH-)=10-2 mol·L-1,![]() ,水的电离度为α3=α2<α1;pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,醋酸是弱电解质,所以有醋酸过量,溶液仍显酸性,溶液的pH<2,对水的电离抑制作用小于pH=2的醋酸溶液,
,水的电离度为α3=α2<α1;pH=2的醋酸溶液和pH=12的氢氧化钠溶液等体积混合,醋酸是弱电解质,所以有醋酸过量,溶液仍显酸性,溶液的pH<2,对水的电离抑制作用小于pH=2的醋酸溶液,![]() ,溶液中水的电离度为α4,所以有a2 = a3<a4<a1;答案选A。
,溶液中水的电离度为α4,所以有a2 = a3<a4<a1;答案选A。


科目:高中化学 来源: 题型:
【题目】(1)配平: Zn + HNO3(很稀) == Zn(NO3)2 + NH4NO3 + H2O
(2)写出实验室制取NH3的化学方程式: 。
(3)除去一氧化氮中的少量二氧化氮的最好方法(用方程式表示) ;
(4)在含Cu+的酶(催化剂)的活化中心,亚硝酸根离子(NO2-)可转化为NO,写出Cu+在酸性水溶液中与NO2-反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
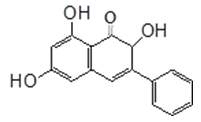
A.高良姜素的分子式为C15H15O5
B.高良姜素分子中含有3个羟基、8个双键
C.高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应
D.1mol高良姜素与足量的钠反应生成33.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,下列有关说法中不正确的是( )
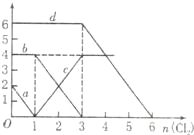
A.d曲线代表溶液中Br﹣变化情况
B.原溶液中FeI2的物质的量为2mol
C.原溶液中n(Fe2+):n(Br﹣)=2:3
D.当通入2mol Cl2时,溶液中离子反应为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法错误的是( )
A.葡萄糖的分子式是C6H12O6
B.葡萄糖属于有机高分子化合物
C.葡萄糖是人体重要的能量来源
D.葡萄糖能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于石油的说法不正确的是( )
A.石油主要含C、H两种元素
B.石油是主要由各种烷烃、环烷烃和芳香烃所组成的混合物
C.石油有固定的沸点,故可分馏
D.石油分馏得到的汽油是混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A+B→X+Y+H2O(未配平,反应条件略去)是中学常见反应的化学方程式,请回答:
(1)若Y为黄绿色气体:
①当 A、B的物质的量之比为1:4且A为黑色固体时,该反应的离子方程式是 ;
②当 A、B的物质的量之比为1:6时,写出该反应的化学方程式,并用双线桥表示反应过程中的电子转移: .
(2)若A为单质,B为无色油状黏稠液体,当 A、B的物质的量之比为1:2时,则A可能为 ,检查其中刺激性气体产物X的方法是 .
(3)常温下A在B的浓溶液中会“钝化”,且A可溶于X溶液中,若A为金属单质,A和B以物质的量之比1:4反应.过量的A和100mL,2mol/L的B溶液充分反应后,将溶液稀释至500mL,溶液中阴离子的物质的量浓度为 .
(4)若A、B、X、Y均为化合物,向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色,则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com