
【题目】I.(化学反应原理)
恒温恒容下,将2mol气体A和2mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
xC(g)+2D(s),2min后反应达到平衡状态,此时剩余1.2mol B,并测得C的浓度为1.2mol/L。
(1)从开始反应到平衡状态,生成C的平均反应速率为___。
(2)该反应的化学平衡表达式为___。
(3)下列各项可作为该反应达到平衡状态的标志是___。
A.压强不再变化 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.A的消耗速率与B的消耗速率之比为2:1
II.(化学与生活)
有四种常见药物①阿司匹林②青霉素③胃舒平④麻黄碱。请回答:
(1)某同学胃酸过多,应选用的药物是___(填序号)。
(2)由于具有兴奋作用,国际奥委会严禁运动员服用的药物是___(填序号)。
(3)从用药安全角度考虑,使用前要进行皮肤敏感性测试的药物是___(填序号)。
【答案】0.6mol/(Lmin) K=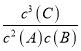 BC ③ ④ ②
BC ③ ④ ②
【解析】
I.(1)根据v=![]() 计算C得平均反应速率;
计算C得平均反应速率;
(2)平衡常数为生成物浓度幂之积与反应物浓度幂之积的比值;
(3)根据变化量之比等于计量数之比可知x=3,该反应为等体积反应,据此分析判断;
II. ①阿司匹林为解热镇痛药;②青霉素为抗生素,即消炎药;③胃舒平为抗酸药,④麻黄碱为天然药物,属于兴奋剂,据此作答;
I.(1)v=![]() =
=![]() =0.6mol/(Lmin);
=0.6mol/(Lmin);
(2)根据已知条件由三段法可知
2A(g) + B(g) ![]() xC(g) + 2D(s)
xC(g) + 2D(s)
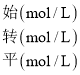
![]()
![]()
![]()
根据变化量之比等于计量数之比可知x=3,那么平衡常数K=
(3)根据变化量之比等于计量数之比可知x=3,该反应为等体积反应,
A. 由于该反应为等体积反应,因此压强不再变化不能证明反应达到平衡状态,A项错误;
B. 该反应气体的质量减小,体积不变,因此气体密度不再变化可以证明反应达到平衡状态,B项正确;
C. 反应前后气体质量变化,气体物质的量不变,那么气体的平均相对分子质量为变量,因此当气体的平均相对分子质量不再变化时,证明反应达到平衡状态,C项正确;
D. 消耗A的速率为正反应速率,消耗B的速率也是正反应速率,没有逆反应速率,不能证明正反应速率等于逆反应速率,D项错误;
答案选BC。
II.(1)某同学胃酸过多,应选用的药物是抗酸药,即选择胃舒平;
(2)严禁运动员服用的药物是兴奋剂,即麻黄碱;
(3)青霉素早使用之前要进行皮肤敏感性测试。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列有关的离子方程式或化学方程式中正确的是
A.向![]() 溶液中加入过量NaOH溶液,有白色沉淀生成:
溶液中加入过量NaOH溶液,有白色沉淀生成:![]()
B.磷酸一氢钠溶液水解:![]()
C.将![]() 气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:
气体通入一密闭容器中,达平衡后吸收QkJ热量,则该反应的热化学方程式为:![]()
![]()
D.向含有![]() mol
mol![]() 的溶液中通入
的溶液中通入![]() mol
mol![]() 充分反应:
充分反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的ΔH前者大于后者的是( )
①C(s)+O2(g)= CO2(g)ΔH1;C(s)+ ![]() O2(g)= CO(g)ΔH2
O2(g)= CO(g)ΔH2
②S(s)+O2(g)= SO2(g)ΔH3;S(g)+O2(g)=SO2(g)ΔH4
③H2(g)+ ![]() O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
O2(g)=H2O(l)ΔH5;2H2(g)+O2(g)= 2H2O(l)ΔH6
④CaCO3(s)= CaO(s)+CO2(g)ΔH7;CaO(s)+H2O(l)= Ca(OH)2(s)ΔH8
A.①B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是___________________________。
(4)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______填“a”或“b”;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(化学反应原理)
(1)在101kPa时,足量H2在1molO2中完全燃烧生成2mol液态水,放出571.6kJ的热量,H2的燃烧热△H=__。
(2)1.00L1.00mol·L-1硫酸与2.00L1.00mol·L-1NaOH溶液完全反应,放出114.6kJ的热量,表示其中和热的热化学方程式为__。
II.(化学与生活)
保证食品安全、保持营养均衡,是保障人体健康的基础。
(1)维生素C能促进人体生长发育。下列富含维生素C的是___。
A.牛肉 B.辣椒 C.鸡蛋
(2)缺乏某种微量元素将导致甲状腺肿大,且造成智力损害,该微量元素是__。
A.碘 B.铁 C.钙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol/L的硫酸于试管中② | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
(1)甲同学表中实验步骤②为____________________
(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学组装了如图所示的电化学装置,则下列说法正确的是( )

A.图中甲池为原电池装置,Cu电极发生还原反应
B.实验过程中,甲池左侧烧杯中NO3-的浓度不变
C.若甲池中Ag电极质量增加5.4g时,乙池某电极析出1.6g金属,则乙中的某盐溶液可能是AgNO3溶液
D.若用铜制U形物代替“盐桥”,工作一段时间后取出U型物称量,质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家研究出对环境污染小、便于铝回收的海水电池,其工作原理示意图如下:
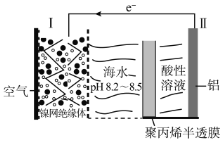
下列说法正确的是( )
A.电极Ⅰ为阴极,其反应为:O2+4H++4e-=2H2O
B.聚丙烯半透膜允许阳离子从右往左通过
C.如果电极II为活性镁铝合金,则负极区会逸出大量气体
D.当负极质量减少5.4g时,正极消耗3.36L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的装置,判断下列说法正确的是( )
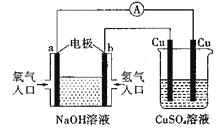
A.该装置中a极为负极
B.当装置中某一块铜片的质量变化了12.8g时,a极上消耗O2在标准状况下的体积为4.48L
C.该装置中b极的电极反应式是:H2-2e-=2H+
D.一段时间后,左边装置中溶液pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com