
| A. | MnO2吸收SO2的反应:MnO2+SO2═MnSO4 | |
| B. | MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H+═MnOOH | |
| C. | MnSO4与KMnO4反应制备MnO2:2MnO4-+3Mn2++2H2O═5MnO2+4H+ | |
| D. | 尾气中的SO2 还可用足量的氨水吸收:SO2+2NH3•H2O═2NH4++SO32-+H2O |
分析 A.S元素被二氧化锰氧化为硫酸根离子;
B.碱性条件下,电极方程式中不能有氢离子参加;
C.MnSO4与KMnO4反应生成MnO2;
D.SO2是酸性气体,与氨水反应生成盐溶液.
解答 解:A.S元素被二氧化锰氧化为硫酸根离子,则MnO2吸收SO2的反应:MnO2+SO2═MnSO4,故A正确;
B.碱性条件下,电极方程式中不能有氢离子参加,所以MnO2作为碱性电池正极材料时的放电反应:MnO2+e-+H2O═MnOOH+OH-,故B错误;
C.MnSO4被KMnO4氧化生成MnO2,则MnSO4与KMnO4反应制备MnO2:2MnO4-+3Mn2++2H2O═5MnO2+4H+,故C正确;
D.SO2是酸性气体,与氨水反应生成盐溶液,所以尾气中的SO2 还可用足量的氨水吸收:SO2+2NH3•H2O═2NH4++SO32-+H2O,故D正确.
故选B.
点评 本题考查了元素化合物的性质、氧化还原反应、离子方程式的书写,题目难度中等,侧重于基础知识的综合应用的考查,注意溶液的酸碱性对电极方程式的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
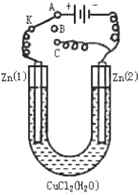 在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:
在一个U形管里盛有氯化铜溶液,并插入两块锌片作电极,按如图连接:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2H2(g)+O2(g)=2H2O(g )△H1 2H2(g)+O2(g)=2H2O(1)△H2 | |
| B. | S(g)+O2(g)=SO2(g )△H1 S(s)+O2(g)=SO2(g )△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)=CO (g )△H1 C(s)+O2(g)=CO2 (g )△H2 | |
| D. | H2(g)+Cl2(g)=2HCl(g )△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)=HCl(g )△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈现+2价 | B. | 氢氧化物呈强碱性 | ||
| C. | 单质与冷水不反应 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正极通入H2,发生还原反应 | |
| B. | 负极通入H2,发生还原反应 | |
| C. | 总反应式为2H2+O2=2H2O | |
| D. | 导电离子为质子,且在电池内部由正极定向移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入甲烷的一极为正极,该极c(OH-)减小 | |
| B. | 通入甲烷的一极的电极反应为CH4-8e-+3H2O=CO32-+10H+ | |
| C. | 通入氧气一极发生还原反应,电极反应为O2+2H2O+4e-=4OH- | |
| D. | 该电池工作时,溶液中的阴离子向正极移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com