
| A. | NaHCO3溶液加水稀释,$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值保持增大 | |
| B. | 在0.1 mol•L一1氨水中滴加0.lmol•L一1盐酸,恰好完全中和时溶液的pH<7 | |
| C. | 向0.lmol/L Na2S03溶液中加人少量NaOH固体,c(Na+)、c(SO32-)均增大 | |
| D. | 0.lmol•L一1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
分析 A、NaHCO3溶液加水稀释,促进HCO3-的水解;
B、恰好完全反应生成氯化铵,强酸弱碱盐;
C、亚硫酸钠溶液中加入氢氧化钠,钠离子浓度增大,同时氢氧根离子浓度增大抑制了亚硫酸根离子的水解,导致亚硫酸根离子浓度也增大;
D、氨水加水稀释,促进电离,体积增大,但溶液中氢氧根离子浓度减小,所以c(H+)增大.
解答 解:A、NaHCO3溶液加水稀释,促进HCO3-的水解,n(HCO3-)较小,n(Na+)不变,则$\frac{c(N{a}^{+})}{c(HC{{O}_{3}}^{-})}$的比值保持增大,故A正确;
B、恰好完全反应生成氯化铵,强酸弱碱盐水解呈酸性,所以溶液的pH<7,故B正确;
C、向0.1mol/LNa2SO3溶液中加入少量NaOH固体,溶液中钠离子、氢氧根离子浓度增大,氢氧根离子抑制了亚硫酸根离子的水解,则亚硫酸根离子浓度增大,所以c(Na+)、c(SO32-)均增大,故C正确;
D、氨水加水稀释,促进电离,体积增大,但溶液中氢氧根离子浓度减小,所以c(H+)增大,故D错误;
故选D.
点评 本题考查了弱电解质的电离和盐的水解,明确弱电解质电离特点及影响弱电解质电离的因素是解本题关键,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑥ | B. | ①③⑤ | C. | ①②④ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中硫元素只被氧化 | |
| B. | Na2S2O3在强酸性环境中能稳定存在 | |
| C. | 每生成1 molNa2S2O3,转移电子数为4NA | |
| D. | 若将Na2CO3换成Na2SO3(配比不变),每吸收3 molSO2,理论上就会生成474 g Na2S2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
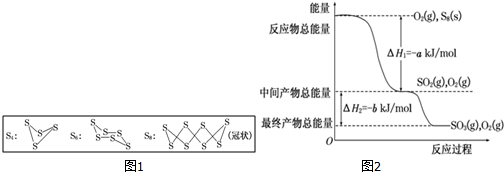
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
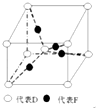 在元素周期表前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.
在元素周期表前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C的氧化物是导致酸雨的主要物质之一,D原子核外电子有8种不同的运动状态,E的基态原子在前四周期元素的基态原子中单电子数最多,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子.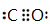 ; A2D由液态形成晶体时密度减小,其主要原因水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小(用文字叙述).
; A2D由液态形成晶体时密度减小,其主要原因水形成晶体时,每个水分子与4个水分子形成氢键,构成空间正四面体网状结构,水分子空间利用率低,密度反而减小(用文字叙述).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
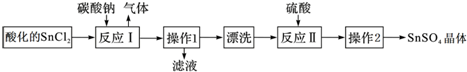
| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+=CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2~3次 | |
| D. | 操作1为过滤,操作2为结晶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com