
【题目】用三个集气瓶收集满二氧化硫、二氧化氮气体,然后将其倒置在水槽中。分别缓慢通入适量O2或Cl2,如图所示。一段时间后,D、E装置的集气瓶中充满溶液,F装置的集气瓶中还有气体剩余。(假设瓶内液体不扩散)

(1)写出装置E中反应的离子方程式:__________________________________________
(2)假设该实验条件下,气体摩尔体积为aL·mol-1。则装置D的集气瓶中所得溶液溶质的物质的量浓度为____________;发生反应的方程式____________________________。
(3)通入氧气前在F装置的水槽里滴加几滴紫色石蕊溶液,观察到的现象是_____________,通入氧气后,可能观察到的实验现象是_________________________________________,写出反应的总化学方程式:_________________________________________________。
【答案】Cl2+SO2+2H2O=4H++2Cl-+SO42- ![]() mol/L 4NO2+O2+2H2O=4HNO3 紫色石蕊试液变红 红色由浅变深 2SO2+O2+2H2O=2H2SO4
mol/L 4NO2+O2+2H2O=4HNO3 紫色石蕊试液变红 红色由浅变深 2SO2+O2+2H2O=2H2SO4
【解析】
(1)二氧化硫和氯气按一定比例可完全溶解于水中发生氧化还原反应生成硫酸和盐酸;
(2)氧气、二氧化氮一定比例下可完全溶于水中,反应为:4NO2+O2+2H2O=4HNO3,根据氮元素守恒,n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为根据c=![]() 计算;
计算;
(3)F装置中二氧化硫与水反应生成亚硫酸,酸性较弱,再通入氧气,亚硫酸被氧化成硫酸,溶液酸性增强。
(1)二氧化硫和氯气按一定比例可完全溶解于水中形成溶液:Cl2+SO2+2H2O=4H++2Cl-+SO42-;
(2)水会充满集气瓶,设集气瓶体积为VL,最后溶液的体积为VL,由4NO2+O2+2H2O=4HNO3知,n(NO2)=n(HNO3),则所得溶液溶质的物质的量浓度为:c=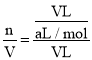 =
=![]() mol/L;
mol/L;
(3)F装置中二氧化硫与水反应生成亚硫酸,酸性溶液加入紫色石蕊试液会变红,再通入氧气,亚硫酸被氧化成硫酸,溶液酸性增强,红色由浅变深,反应的化学方程式为:2SO2+O2+2H2O=2H2SO4。


科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物的有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是________。
A.纯铁硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下可与水蒸气反应
E.铁在冷的浓硫酸中钝化
(2)向沸水中逐滴加1mol/LFeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为____________,形成该分散系的微粒直径范围是_________。
(3)电子工业需用30%FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的离子方程式_________。欲从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气、②铁粉、③浓硝酸、④浓盐酸、⑤烧碱、⑥浓氨水,需用用到的一组试剂是__________。
A. ①②④ B. ①③④⑥ C. ②④⑤ D. ①④⑥
(4)高铁酸钠Na2FeO3是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O,则X的化学式为__________。
②高铁酸钠在水中可以发生如下反应:FeO42-+10H2O=4Fe(OH)3+8OH-+3O2。由此看来,高铁酸钠能够杀菌消毒是因为它具有_____性,而能够除去水中悬浮物是因为________。
③下列物质能作净水削的有_________。
a.KAl(SO4)2·12H2O b.聚合硫酸铁[Fe(OH)(SO4)]n c.ClO2 d.“84消毒液”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用AG表示溶液的酸度,其表达式为:AG=lg[ ]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是( )
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10mL0.10mol/LMOH溶液,滴定曲线如图所示,下列说法正确的是( )

A. MOH电离方程式是MOH=M++OH-
B. C点加入盐酸的体积为10mL
C. 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH-)
D. 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸与Cu反应的叙述正确的是( )
A. 在反应中,浓硫酸只表现出氧化性
B. 该反应中还原剂与氧化剂物质的量之比为1:2
C. 在反应中,浓硫酸既表现出氧化性,又表现出酸性
D. 每1 mol 铜参加反应就有2 mol浓硫酸被还原,同时生成2 mol SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
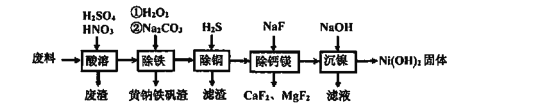
【题目】含镍(Ni)质量分数约20%废料,主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有N2生成。写出金属镍溶解的化学方程式______________________
(2)“除铁”时H2O2的作用是________________,为了证明添加的H2O2已足量,应选择的试剂是_______________ (填序号:“①铁氰化钾K3[Fe(CN)6]”或“②硫氰化钾KSCN”)溶液.黄钠铁矾[NaxFey(SO4)m(OH)n]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,则x:y:m:n=1:____:2:6
(3)“除铜”时,反应的离子方程式为________________
(4)已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF“除钙镁”后,所得滤液中![]() ________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
________________(保留1位小数)。已知除杂过程在陶瓷容器中进行,NaF的实际用量不宜过大的原因是__________
(5)100kg废料经上述工艺制得Ni(OH)2固体的质量为31kg,则镍回收率为______________(保留1位小数)
(6)镍氢电池已成为混合动力汽车的主要电池类型,其工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型抗溃疡药瑞巴匹特,可保护胃肠黏膜免受各种致溃疡因子的危害,其合成路线如下:
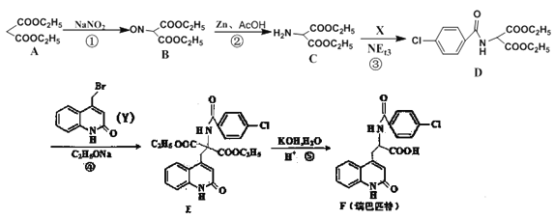
(1)A的化学名称为______________,C的核磁共振氢谱具有_________________组峰
(2)A与足量的NaOH溶液反应的化学方程式为______________
(3)化合物F中含氧官能团的名称为__________________,化合物F的分子式为_____________
(4)反应①~③中,属于取代反应的是__________________(填序号)
(5)C→D的转化中,生成的另一种产物为HCl,则C→D反应的化学方程式为__________
(6)已知Y中的溴原子被--OH取代得到Z,写出同时满足下列条件的Z的一种同分异构体的结构简式:___________________
I.分子中含有一个苯环和一个五元环,且都是碳原子环
II.苯环上有两个取代基,且处于对位
III.能与NaHCO3溶液发生反应
(7)已知CH3CH2OH![]() CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备
CH3CH2Br,以A和HOCH2CH2CH2OH为原料制备![]() 的合成路线流程图如下:HOCH2CH2CH2OH
的合成路线流程图如下:HOCH2CH2CH2OH![]() 物质X
物质X![]() 物质Y
物质Y![]()
![]() ,则物质X为__________,物质Y为____________
,则物质X为__________,物质Y为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关反应速率的说法正确的是:
A. 用铁片和稀硫酸反应制氢气时,改用98%的硫酸可以加快反应速率
B. 100 mL 2 molL﹣1的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变
C. 反应C(s)+H2O(g) ![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
CO(g)+H2(g)在一可变容积的密闭容器中进行,增加C的量 , 其反应速率增大
D. 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,减小压强反应速率变慢:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )
HCHO(g)+H2(g),甲醇的平衡转化率随温度变化曲线如下图所示。下列有关说法正确的是( )

A. 脱氢反应的△H<0
B. 在t1K时,该反应的平衡常数为8.1
C. 600K时,Y点甲醇的υ(正) <υ(逆)
D. 若增大体系压强,曲线将向上平移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家对一碳化学进行了广泛深入的研究并取得了一些重要成果。已知:CO(g)+2H2(g)![]() CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)
CH3OH(g)△H1=-90.1kJ/mol;3CH3OH(g)![]() CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________。
CH3CH=CH2(g)+3H2O(g) △H2=-31.0kJ/mol,CO与H2合成CH3CH=CH2的热化学方程式为________。
(2)现向三个体积均为2L的恒容密闭容器I、II、Ⅲ中,均分别充入1molCO 和2mo1H2发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
CH3OH(g) △H1=-90.1kJ/mol。三个容器的反应温度分别为Tl、T2、T3且恒定不变。当反应均进行到5min时H2的体积分数如图所示,其中只有一个容器中的反应已经达到平衡状态。
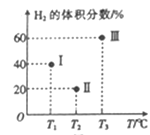
①5min时三个容器中的反应达到化学平衡状态的是容器_______(填序号)。
②0-5 min内容器I中用CH3OH表示的化学反应速率v(CH3OH)=_______。(保留两位有效数字)
③当三个容器中的反应均达到平衡状态时,平衡常数最小的是容器___________。(填序号)
(3)CO用于工业冶炼金属,在不同温度下用CO 还原四种金属氧化物,达到平衡后气体中lg![]() 与温度(T)的关系如图所示。下列说法正确的是_____(填字母)。
与温度(T)的关系如图所示。下列说法正确的是_____(填字母)。
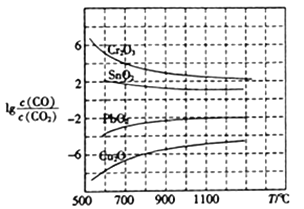
A.工业上可以通过增高反应装置来延长矿石和CO接触面积,减少尾气中CO的含量
B.CO用于工业冶炼金属铬(Cr)时,还原效率不高
C.工业冶炼金属铜(Cu) 时,600℃下CO的利用率比1000℃下CO的利用率更大
D.CO还原PbO2的反应△H>0
(4)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
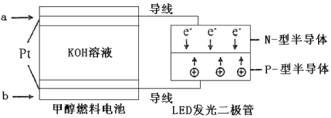
请写出加入(通入)a物质一极的电极反应式_________;每消耗6.4g甲醇转移的电子数为____。
(5)一定条件下,用甲醇与一氧化碳反应合成乙酸可以消除一氧化碳污染。常温下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,若溶液呈中性,用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com