
将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
(1)通甲烷的铂丝为原电池的极,发生的电极反应为 .
(2)该电池工作时(放电)反应的总化学方程式为 .
考点: 化学电源新型电池.
专题: 电化学专题.
分析: (1)根据得失电子判断燃料电极的正负极,根据得失电子及产物的性质写出电极反应式;
(2)根据燃料燃烧及产物的性质写出电池反应式.
解答: 解:(1)燃料燃烧时失电子发生氧化反应,原电池的负极上失电子发生 氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O,
氧化反应,所以通甲烷的铂丝为原电池的负极;甲烷燃烧生成二氧化碳和水,二氧化碳是酸性氧化物能和氢氧化钾反应生成碳酸钾和水,所以该电极上的电极反应式为:CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O,
故答案为:负;CH4+10OH﹣﹣8e﹣=CO32﹣+7H2O;
(2)甲烷失电子发生氧化反应,氧气得电子发生还原反应,氧气得电子和水反应生成氢氧根离子,所以该反应的电池反应式为:CH4+2O2+2OH﹣=CO32﹣+3H2O;
故答案为:CH4+2O2+2OH﹣=CO32﹣+3H2O.
点评: 本题考查了燃料电池,燃料电池电极反应式的书写要注意结合电解质溶液书写,原料相同,电解质溶液不同,电极反应式不同,题目难度不大.


科目:高中化学 来源: 题型:
下列实验事故的处理方法正确的是()
A. 实验桌上的酒精灯倾倒了燃烧起来,马上用湿布扑灭
B. 不慎将酸或碱液溅入眼内,立即闭上眼睛,用手揉擦
C. 皮肤上溅有较多的浓硫酸,赶紧用水冲洗
D. 衣服沾上大量的浓氢氧化钠溶液,需将此衣服浸泡在盛水的盆中
查看答案和解析>>
科目:高中化学 来源: 题型:
在1L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2mol•L﹣1和1.5mol•L﹣1,现向该溶液中加入39.2g铁粉使其充分反应.下列有关说法正确的是()
A. 反应后溶液中Fe3+物质的量为0.8mol
B. 反应后产生13.44L H2(标准状况)
C. 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol
D. 由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在中性条件下钢铁易发生吸氧腐蚀时,正极上发生的电极反应是()
A. 2H++2e﹣→H2 B. Fe2++3e→Fe
C. 2H2O+O2+4e﹣→4OH﹣ D. Fe3+﹣e→Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
利用图所示装置进行下列实验,能得出相应实验结论的是()
选项 ① ② ③ 实验结论 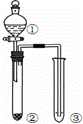
A 稀硫酸 Na2CO3 C6H5ONa 酸性:H2CO3>C6H5OH
B 液溴和苯 铁屑 AgNO3溶液 液溴和苯发生取代反应
C 稀盐酸 Na2SO3 Ba(NO3)2溶液 SO2与可溶性钡盐可以生成白色沉淀
D 浓盐酸 KMnO4 FeBr2溶液 氧化性:Cl2>Br2>Fe3+
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A(C4 H6O5),广泛存在于许多水果中,是一种常用的食品添加剂.该化合物具有如下性质:
i.25℃时,电离常数K1=3.99×10﹣4,K2=5.5×10﹣6
ii.Imol A与足量钠产生1.5mol H2;
ii.分子中核磁共振氢谱显示有5种不同化学环境的氢原子.与A相关的反应流程如下:
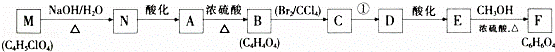
回答下列问题:
(1)A中官能团的名称为 ;B的结构简式为 ,C的系统命名为 _.
(2)A﹣﹣B的反应类型为消去反应;反应①所需的反应条件为 .
(3)写出下列反应的化学方程式:
①M﹣N. ;
②E﹣F. ,
(4)A有多种同分异构体,写出符合下列条件的同分异构体结构简式: .
①能发生水解,生成两种有机物;②水解后产物之间能发生缩聚反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为()

A. H2(g)+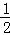 O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
O2(g)═H2O(g)△H=(a+b) kJ•mol﹣1
B. 2H2(g)+O2(g)═2H2O(g)△H=2(b﹣a) kJ•mol﹣1
C. H2(g)+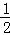 O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
O2(g)═H2O(l)△H=(b+c﹣a) kJ•mol﹣1
D. 2H2(g)+O2(g)═2H2O(l)△H=2(a﹣b﹣c) kJ•mol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
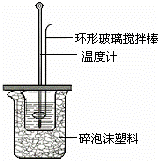
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
(2)从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 托盘天平(带砝码) 小烧杯 坩埚钳 玻璃棒 药匙 量筒
仪器 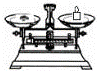

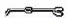
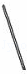

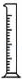
序号 a b c d e f
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol): .
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度
实验次数 起始温度t1/℃ 终止温度
t2/℃ 温度差平均值
(t2﹣t1)/℃
H2SO4 NaOH 平均值
1 26.2 26.0 26.1 30.1 4.0
2 27.0 27.4 27.2 33.3
3 25.9 25.9 25.9 29.8
4 26.4 26.2 26.3 30.4
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H= (取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com