
| A. | C3H6和 C5H10 | B. | C3H4和 C4H6 | C. | C2H6和 C8H18 | D. | C2H6和 C3H6 |
分析 同系物指结构相似,在分子组成上相差一个或若干个CH2原子团的物质,具有如下特征:结构相似、化学性质相似、分子式通式相同,分子式不同、物理性质不同,研究范围为有机物.
解答 解:A.C3H6和 C5H10,可能为环烷烃或烯烃,二者结构不一定相似,则不一定互为同系物,故A错误;
B.C3H4和 C4H6的结构不能确定,则二者不一定互为同系物,故B错误;
C.C2H6和 C8H18为不同碳原子的烷烃,二者结构相似,相差6个CH2原子团,二者互为同系物,故C正确;
D.C2H6和C3H6,前者为乙烷,后者为丙烯和环丙烷,二者结构不同,一定不属于同系物,故D错误;
故选C.
点评 本题考查了同系物的判断,题目难度不大,明确同系物的概念为解答关键,试题侧重基础知识的考查,有利于提高学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)$?_{催化剂}^{500℃、30M}$2NH3(g)?△H=-38.6 kJ•mol-1 | |
| C. | S(s)+O2(g)═SO2(g)△H=-269.8 kJ•mol-1 | |
| D. | 2NO2═O2+2NO△H=+116.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 类别选项 | 碱 | 盐 | 电解质 | 非电解质 |
| A | 烧碱 | 小苏打 | BaSO4 | 干冰 |
| B | 纯碱 | CaCO3 | NH3•H2O | Fe |
| C | 明矾 | 食盐 | 石墨 | 醋酸 |
| D | KOH | CuSO4 | Na2SO4 | KClO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
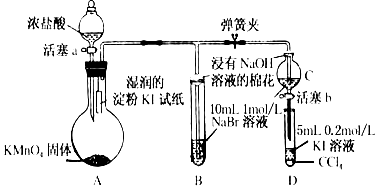
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
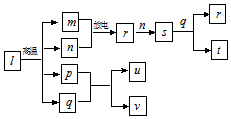 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,p是W的单质,其余为由上述的两种或三种元素组成的化合物.u的水溶液具有漂白性;常温时,0.01mol•L-1t与0,.01mol•L-1 v溶液的pH均为2.下列说法不正确的是( )| A. | 原子半径:r(X)<r(Z)<r(Y) | |
| B. | 简单氢化物的稳定性:Z>W>Y | |
| C. | 上述转化关系中的物质的类别有单质、酸及酸性氧化物等 | |
| D. | X、Y、Z三种元素形成的化合物中可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NH4+、Cl-、H+、OH-的溶液中,离子浓度一定是c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 常温下,pH=6的醋酸与醋酸钠的混合溶液中:c(Na+)>c(CH3COO-) | |
| C. | 将0.2 mol•L-1 CH3COOH溶液和0.1 mol•L-1 NaOH溶液等体积混合,则反应后的混合溶液中:2c(OH-)+c(CH3COO-)═2c(H+)+c(CH3COOH) | |
| D. | 常温下pH=6的NH4Cl溶液中:c(Cl-)>c(NH4+)>c(NH3•H2O)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物溶于水后的溶液pH<7,则称为酸性食物 | |
| B. | 由碳、氮、硫、磷等元素组成的蛋自质是酸性食物 | |
| C. | 蔬菜、水果是酸性食物 | |
| D. | 柠檬酸是酸性食物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
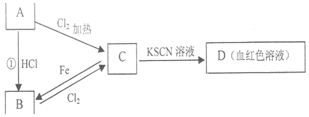 A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:
A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如图所示转化关系.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com