
| A. | N2O | B. | CF2=CF2 | C. | CCl2F2 | D. | SF6 |
分析 由极性键构成的分子,若结构对称,正负电荷的中心重合,则为非极性分子,在化合物中,原子最外层电子数等于原子的价层电子数+|化合价|,以此进行分析.
解答 解:A.N2O中N为+1价,N原子的电子数为5+1=6,不满足8电子稳定结构,故A错误;
B.CF2=CF2是平面方形结构,结构对称,正负电荷的中心重合,则为非极性分子,分子中C、F均满足8电子稳定结构,故B正确;
C.CCl2F2是四面体结构,由于Cl与F原子大小不同,所以结构不对称,正负电荷的中心不重合,为极性分子,故C错误;
D.SF6中S原子的电子数为6+6=12,不满足8电子稳定结构,故D错误.
故选B.
点评 本题考查化学键的极性、分子极性、8电子稳定结构,题目难度不大,明确化学键、分子极性判断的方法是解答本题的关键,注意熟悉常见分子的构型,试题培养了学生灵活应用所学知识解决实际问题的能力.


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
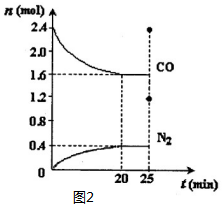 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.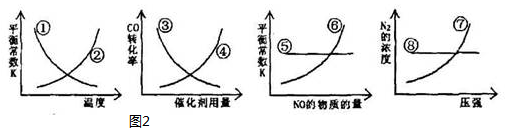
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制取氢气时,改用 98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100mL2mol•L-1 的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2 的催化氧化是一个放热的反应,所以升高温度,反应速率减慢 | |
| D. | 汽车尾气中的 NO 和 CO 可以缓慢反应生成 N2 和 CO2,减小压强反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、K+、NO${\;}_{3}^{-}$、Cl- | B. | Na+、K+、OH-、Cl- | ||
| C. | Mg2+、Na+、OH-、SO${\;}_{4}^{2-}$ | D. | Ba2+、H+、CO${\;}_{3}^{2-}$、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硝酸反应:Fe+2H+═Fe2++H2↑ | |
| B. | 氢氧化铁溶液与盐酸反应:OH-+H+═H2O | |
| C. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| D. | 氢氧化钡溶液与稀硫酸反应:H++SO42-+OH-+Ba2+═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com