
| A. | 上述反应,每生成lmolN2O,消耗67.2LCO | |
| B. | 等物质的量的NO和CO含有相等的电子数 | |
| C. | N2O只有氧化性,无还原性 | |
| D. | CO会迅速与人体血红蛋白结合,使人中毒 |
分析 A、由方程式3CO+2NO2═3CO2+N2O可知,生成lmolN20,需要3molCO,物质的量一定,影响气体的体积因素有温度、压强等,CO的状态不一定是标准状况;
B、计算NO和CO每个分子含有电子数,分析判断;
C、N2O中N元素化合价为+1价,氮元素的化合价常用中间价态,化合价可以升高,也可以降低;
D、CO、NO会迅速与人体血红蛋白结合,使人中毒.
解答 解:A、由方程式3CO+2NO2═3CO2+N2O可知,生成lmolN20,需要3molCO,物质的量一定,影响气体的体积因素有温度、压强等,CO的状态不一定是标准状况,消耗CO的体积不一定是67.2L,故A错误;
B、NO和CO每个分子都有电子15、14,物质的量相同含有的电子数不相同,故B错误;
C、N2O中N元素化合价为+1价,氮元素的化合价常用中间价态,化合价可以升高,也可以降低,N2O既有氧化性,又有还原性,故C错误;
D、人体血红蛋白结合,使人中毒的是CO、NO,CO会迅速与人体血红蛋白结合,使人中毒,故D正确.
故选D.
点评 本题考查氧化还原反应、氧化性还原性判断、常用化学计量计算、物质性质等,题目难度不大,注意气体摩尔体积的使用条件的分析应用.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+C12$\stackrel{光}{→}$ CH3Cl+HCl | |
| B. | CH2=CH2+H2O→CH3-CH2OH | |
| C. |  +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$  +HBr +HBr | |
| D. | 2 CH3CH2OH+O2$→_{△}^{Cu}$ 2 CH3CHO+2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L(标准状况) |
| 1 | 7.24 | 50.00 | 1.792 |
| 2 | 14.48 | 50.00 | 3.584 |
| 3 | 21.72 | 50.00 | 4.032 |
| 4 | 36.20 | 50.00 | 2.240 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:CH4>SiH4 | B. | 碱性:Mg(OH )2>Ca(OH )2 | ||
| C. | 羟基中H的活泼性:H2O>CH3CH2OH | D. | 原子半径:S>Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当镀层都被破坏时,镀锌铁比镀锡铁更易被锈蚀 | |
| B. | 钢铁发生析氢腐蚀时和吸氧腐蚀时负极反应均是Fe-2e-=Fe2+ | |
| C. | 钢铁闸门上装上锌块是利用牺牲阳极的阴极保护法来防止其被腐蚀 | |
| D. | 钢管与电源负极连接是利用外加电流的阴极保护法来防止其被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(N2生成)=3υ(H2消耗) | |
| B. | H2、H2、HN3的分子数之比为1:3:2 | |
| C. | 单位时间内生成2molNH3,同时消耗1molH2 | |
| D. | 容器内的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

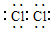 ,M的学化式为NaClO.
,M的学化式为NaClO.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com