
| A. | 若忽略水的电离及H2CO3的第二级电离,则H2CO3?HCO3-+H+的平衡常数K1=4.2×10-7 | |
| B. | 少量Cl2通入到过量的Na2CO3溶液的离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO- | |
| C. | Cl2与Na2CO3按物质的量之比1:1恰好反应的离子方程式为Cl2+CO32-+H2O═HCO3-+Cl-+HClO | |
| D. | 少量CO2通入到过量的NaClO溶液的离子方程式为2ClO-+CO2+H2O═CO32-+2HClO |
分析 解:A.若忽略水的电离及H2CO3的第二级电离,该溶液中c(HH+)=c(HCO3-),c(H2CO3)≈1.5×10-5 mol•L-1,则H2CO3?HCO3-+H+的平衡常数K1=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$;
B.少量Cl2通入到过量的Na2CO3溶液中,氯气和水反应生成HCl、HClO,HCl和碳酸钠反应生成碳酸氢钠和氯化钠,HClO和碳酸钠反应生成次氯酸钠和碳酸氢钠;
C.Cl2与Na2CO3按物质的量之比1:1恰好反应,只有氯气和水反应生成的HCl和碳酸钠反应,HClO不反应;
D.少量CO2通入到过量的NaClO溶液中,二者反应生成碳酸氢钠和HClO.
解答 解:解:A.若忽略水的电离及H2CO3的第二级电离,该溶液中c(HH+)=c(HCO3-),c(H2CO3)≈1.5×10-5 mol•L-1,则H2CO3?HCO3-+H+的平衡常数K1=$\frac{c({H}^{+}).c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{(2.5×1{0}^{-6})^{2}}{1.5×1{0}^{-5}}$=4.2×10-7,故A正确;
B.少量Cl2通入到过量的Na2CO3溶液中,氯气和水反应生成HCl、HClO,HCl和碳酸钠反应生成碳酸氢钠和氯化钠,HClO和碳酸钠反应生成次氯酸钠和碳酸氢钠,所以离子方程式为Cl2+2CO32-+H2O═2HCO3-+Cl-+ClO-,故B正确;
C.Cl2与Na2CO3按物质的量之比1:1恰好反应,只有氯气和水反应生成的HCl和碳酸钠反应,HClO不反应,离子方程式为Cl2+CO32-+H2O═HCO3-+Cl-+HClO,故C正确;
D.少量CO2通入到过量的NaClO溶液中,二者反应生成碳酸氢钠和HClO,离子方程式为ClO-+CO2+H2O═HCO3-+HClO,故D错误;
故选D.
点评 本题考查弱电解质的电离,侧重考查学生分析判断能力,明确电离平衡常数与酸的酸性强弱关系、强酸制取弱酸原理是解本题关键,注意:碳酸根离子对应的酸是碳酸氢根离子而不是碳酸,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 牛奶久置空气中变质腐败 | |
| D. | 向沸水中滴入FeCl3饱和溶液,适当加热,制备胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、Ba2+、Mg2+、HCO3- | ||
| C. | NO3-、Cl-、Fe2+、K+ | D. | NO3-、AlO2-、OH-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为△H=-890kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890 kJ?mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 已知:H2(g)+F2(g)=2HF(g);△H=-270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 KJ | |
| D. | 在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)+c(H+)=c(OH-)+2c(S2-)+c(HS-) | B. | c(OH-)=c(HS-)+c(H+)+2c(H2S) | ||
| C. | c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | D. | c(OH-)=c(HS-)+c(H+)+c(H2S) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| B. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| C. | 由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3- | |
| D. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
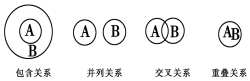
| A. | 化合物与电解质属于包含关系 | |
| B. | 氧化还原反应与化合反应属于包含关系 | |
| C. | 溶液与分散系属于并列关系 | |
| D. | 化合物与碱性氧化物属于交叉关系 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com