
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1.2mol |
| 2mol |
| 0.42×0.42 |
| 0.43×0.8 |


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
| A、X单质易与水反应 |
| B、X形成的氧化物易与水反应生成酸 |
| C、X易形成氧化物XO |
| D、XH4的稳定性比SiH4的低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
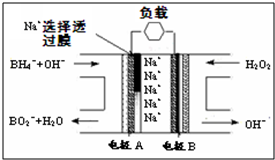
| A、电极B材料中包含MnO2层,MnO2可起催化作用 |
| B、电池负极区电极反应:BH4-+8OH--8e-═BO2-+6H2O |
| C、放电过程中,Na+从正极区向负极区迁移 |
| D、在电池反应中,每消耗1L 6mol/L H2O2溶液,理论上流过电路中的电子为12NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | K1 | K2 |
| 500 | 1.00 | 3.15 |
| 700 | 1.47 | 2.26 |
| 900 | 2.40 | 1.60 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.08mol/L×0.08mol/L |
| 0.22mol/L×0.12mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某有机物X的分子结构如图所示,请回答下列问题:
某有机物X的分子结构如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
235 92 |
235 92 |
| A、中子数为92 |
| B、质子数为92 |
| C、质子数为235 |
| D、中子数为235 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com