
| ��� | ��ѧ����ʽ | ƽ�ⳣ�� | �¶� | |
| 979K | 1173K | |||
| I | Fe(s)+CO2(g) 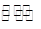 2 FeO(s)+CO(g) 2 FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| II | CO(g)+H2O(g) 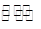 CO2(g)+H2(g) CO2(g)+H2(g) | K2 | 1.62 | b |
| III | Fe(s)+H2O(g)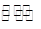 FeO(s)+H2(g) FeO(s)+H2(g) | K3 | a | 1.68 |


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������A��ʾ�ķ�Ӧ����Ϊ1.2mol/��L?s�� |
| B��������B��ʾ�ķ�Ӧ����Ϊ0.6mol/��L?s�� |
| C��2sʱ����A��ת����Ϊ30% |
| D��2sʱ����B��Ũ��Ϊ0.6mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������ڳ�ʪ�Ŀ����б��ڸ�������и��������� |
| B���ü�������AlCl3��Һ�ķ��������Ƶ���ˮAlCl3 |
| C������ˮ��0.1 mol?L-1 NaOH��Һ�е�c(H+)��ǰ�ߴ��ں��� |
| D����������Fe3+��MgCl2������Һ�м���MgCO3���ɽ�Fe3+ת����Fe(OH)3��ȥ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)��SO2��O2��ʼʱ�ֱ�Ϊ20mol��10 mol;��ƽ��ʱ��SO2��ת����Ϊ80%������SO3��ʼ���з�Ӧ������ͬ���¶��£���ʹƽ��ʱ���ɷֵİٷֺ�����ǰ����ͬ��������ʼʱSO3�����ʵ�������ת����Ϊ
2SO3(g)��SO2��O2��ʼʱ�ֱ�Ϊ20mol��10 mol;��ƽ��ʱ��SO2��ת����Ϊ80%������SO3��ʼ���з�Ӧ������ͬ���¶��£���ʹƽ��ʱ���ɷֵİٷֺ�����ǰ����ͬ��������ʼʱSO3�����ʵ�������ת����Ϊ| A��10 mol�� 10% | B��20 mol�� 80% | C��20 mol�� 40% | D��20 mol�� 20% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
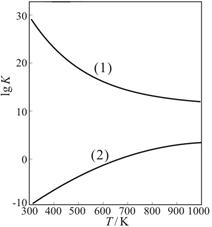
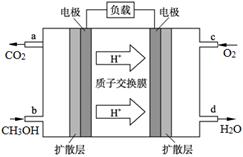
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NO + O2 ��H >0 �ﵽƽ�������,�������ģ� ������
2NO + O2 ��H >0 �ﵽƽ�������,�������ģ� ������| A���ܶ� | B����ɫ | C��ѹǿ | D�������ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
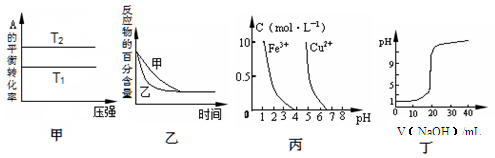
A����ͼ�����жϣ����ڷ�ӦaA(g)�� bB(g) cC(g)����T1��T2�� ��a ��b=c�� ?H��0 cC(g)����T1��T2�� ��a ��b=c�� ?H��0 |
B��ͼ�ұ�ʾѹǿ�Կ��淴Ӧ2A(g)��2 B(g) 3C(g)��D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ�� 3C(g)��D(s)��Ӱ�죬�ҵ�ѹǿ�ȼ�ѹǿ�� |
| C������ͼ��������ȥCuSO4��Һ�е�Fe3����������Һ�м�������NaOH��Һ������pH��4 |
| D��ͼ����ʾ��0.1000 mol/L NaOH��Һ�ζ�20.00 mL0.1000 mol/L������Һ�õ��ĵζ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
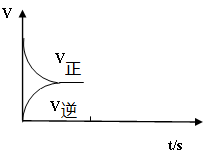
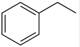 ��g����
��g����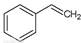 ��g��+H2��g������H=" +117.6" kJ/mol
��g��+H2��g������H=" +117.6" kJ/mol| A����Ϊ�÷�Ӧ�����ȷ�Ӧ�����������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С�� |
| B������������1molCO2��1mol H2��ƽ��������Ӧ�����ƶ��� |
| C��������ͨ��1mol CO2��ƽ��������Ӧ�����ƶ���CO2��ת�������� |
| D��ѹ�������ƽ�ⲻ�ƶ�����Ӧ��Ͳ����Ũ�ȶ����䣻 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
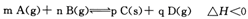 һ��ʱ���ﵽ��ѧƽ��״̬���ı�ijһ����������˵����ȷ����
һ��ʱ���ﵽ��ѧƽ��״̬���ı�ijһ����������˵����ȷ����| A���������¶ȣ���Ӧ��������ܶȲ���ʱ���ﵽ��ƽ��״̬ |
| B��������B��Ũ�ȣ���H��С |
| C����ʹ���ʵ�������A��ת�������� |
| D��������ѹǿ��ƽ�������ƶ�����m+n>p+q |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com