
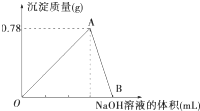
 向20mL某浓度的AlCl3溶液中滴加2mol?L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某浓度的AlCl3溶液中滴加2mol?L-1的NaOH溶液时,得到Al(OH)3沉淀的质量与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:| 0.78g |
| 78g/mol |
| 0.01mol |
| 0.02L |
| 0.78g |
| 78g/mol |
| 0.01mol |
| 0.02L |
| 0.39g |
| 78g/mol |
| 0.015mol |
| 2mol/L |
| 0.035mol |
| 2mol/L |


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓硫酸 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
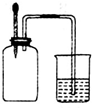 如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )
如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )| A、①② | B、②④ | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
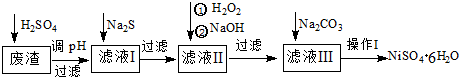
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10、2 | B、6、4 |
| C、8、2 | D、2、8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com